Tính chất hóa học của Ankin
Tính chất hóa học của Ankin được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Tính chất hóa học của Ankin
I. Tính chất hóa học của Ankin
Cần lưu ý chất xúc tác trong mỗi phản ứng vì mỗi điều kiện có thể cho 1 chất sản phẩm khác nhau.
Phản ứng cộng

Phản ứng thế bằng ion kim loại
* Phản ứng của ank-1-in
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
Nhận xét: Phản ứng này dùng để phân biệt ank-1-in với anken và ankan.
Phản ứng oxi hoá
- Các ankin cháy trong không khí tạo ra CO2, H2O và tỏa nhiều nhiệt:
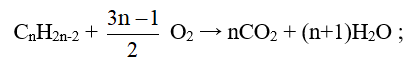
- Giống như anken, ankin làm mất màu dung dịch KMnO4. Khi đó nó bị oxi hóa bởi liên kết ba tạo thành hỗn hợp các sản phẩm phức tạp, còn KMnO4 bị khử thành MnO2 (kết tủa màu nâu đen).
II. Ankin là gì? Công thức cấu tạo và danh pháp
- Ankin là hidrocacbon không no, trong phân tử có liên kết ba C≡C có công thức phân tử dạng tổng quát là: CnH2n-2 (n≥2).
- Trong dãy Ankin thì axetilen có công thức đơn giản nhất C2H2: CH≡CH
Cấu trúc phân tử
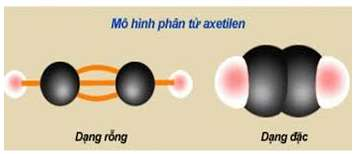
- Trong phân tử ankin, hai nguyên tử C liên kết ba ở trạng thái lai hóa sp (lai hóa đường thẳng). Liên kết ba gồm một liên kết xích ma và 2 liên kết pi. Hai nguyên tử C mang liên kết ba và hai nguyên tử liên kết trực tiếp với chúng nằm trên một đường thẳng.
Mô hình cấu tạo phân tử của Axetilen
Tên gọi của Ankin (danh pháp)
Tên thường: Tên gốc hiđrocacbon gắn với C mang liên kết ba + axetilen
Ví dụ: CH≡CH: axetilen; CH≡C-CH2-CH3: etylaxetilen; CH3-C≡C-CH3: đimetylaxetilen
Tên thay thế: Số chỉ vị trí mạch nhánh + tên nhánh + tên mạch chính + số chỉ vị trí nối ba + in
Ví dụ: CH≡CH: etin; CH≡C-CH3: propin; CH≡C-CH2-CH3: but-1-in
III. Tính chất vật lý của Ankin
- Ở điều kiện thường, ankin từ C2 đến C4 là chất khí, từ C5 đến C16 là chất lỏng, từ C17 trở đi là chất rắn.
- Hầu hết các ankin đều ít tan trong nước, tan được trong một số dung môi hữu cơ. Ví dụ axetilen tan khá nhiều trong axeton.
IV. Điều chế
Điều chế
Điều chế axetilen
- Phương pháp chính điều chế axetilen trong công nghiệp hiện nay là nhiệt phân metan ở 1500 độ C, phản ứng thu nhiệt mạnh:
![]()
- Nhiệt độ sôi của axetilen là -75 độ C nên dễ được tách ra khỏi hỗn hợp với hiđro.
- Ở những nơi dầu khí chưa phát triển, người ta điều chế axetilen theo sơ đồ sau:
![]()
Điều chế các ankin khác
- Tách HX khỏi dẫn xuất đihalogen
CH2Br-CH2Br + 2KOH → CH≡CH + 2KBr + 2H2O
- Phản ứng giữa axetilua với dẫn xuất halogen:
CH3I + AgC ≡ CAg + CH3I → CH3 - C ≡ C - CH3 + 2AgI
V. Ứng dụng
- Axetilen cháy trong oxi tạo ra ngọn lửa có nhiệt độ khoảng 30000C nên được dùng trong đèn xì axetilen - oxi để hàn và cắt kim loại:
C2H2 + O2 → 2CO2 + H2O
- Sử dụng axetilen phải rất cẩn trọng vì khi nồng độ axetilen trong không khí từ 2,5% trở lên có thể gây cháy nổ.
- Axetilen và các ankin khác còn được dùng làm nguyên liệu để tổng hợp các hóa chất cơ bản khác như vinyl clorua, vinyl axetat, vinylaxetilen, anđehit axetic,...
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Tính chất hóa học của Ankin. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










