Phân biệt 5 dung dịch HCl, NaOH, NaSO4, NaCl, NaNO3
Phân biệt 5 dung dịch HCl, NaOH, NaSO4, NaCl, NaNO3 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Phân biệt 5 dung dịch
Câu hỏi: Phân biệt 5 dung dịch HCl, NaOH, Na2SO4, NaCl, NaNO3.
Trả lời:
Để phân biệt các dung dịch HCl, NaOH, Na2SO4, NaCl, NaNO3 ta thực hiện lần lượt các phản ứng sau:
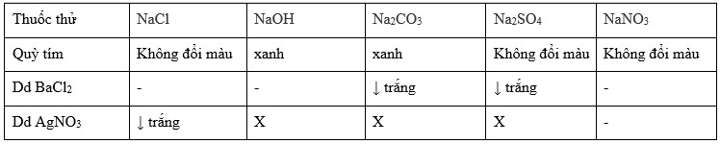
PTHH:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4↓ +2NaCl
AgNO3 + NaCl → AgCl↓ + NaNO3
I. Muối tinh khiết Natri Clorua (NaCl) là gì?
- Muối tinh khiết (hay còn gọi là muối ăn, muối, muối natri clorua, muối mỏ hay halua) là hợp chất với công thức hóa học NaCl. Natri clorua chủ yếu tạo ra độ mặn trong các đại dương và chất lỏng ngoại bào của nhiều cơ thể đa bào.
+ Nguồn gốc của muối tinh khiết NaCl
- Muối NaCl một phần xuất phát từ miệng núi lửa hoặc đá trên đáy biển. Tuy nhiên, phần lớn muối có nguồn gốc trên đất liền.
- Nước ngọt từ những cơn mưa không ở dạng tinh khiết 100% -> Nó hòa tan CO2 trong khí quyển trước khi rơi xuống đất -> Nước mưa chảy trên mặt đất để tiếp cận đường thoát nước trong khu vực -> Tính axit của nước mưa phá vỡ đá, thu giữ ion trong đá và mang chúng ra biển -> Khoảng 90% các ion này là natri hoặc clo -> Hai loại ion này kết hợp với nhau tạo ra muối.
II. Tính chất vật lí
- Nhiệt độ nóng chảy: 800oC và nhiệt độ sôi ở 1454°C.
- Là dạng tinh thể, không màu; có vị mặn; hoàn toàn trong suốt; tan tốt trong nước.
- Nóng chảy bị bay hơi rõ rệt.
- NaCl tinh khiết không hút ẩm nhưng do bị lẫn tạp chất nên bị chảy rữa khi có không khí.
III. Tính chất hóa học Natri Clorua
NaCl là muối gì?
- Natri Clorua là muối của bazơ khá mạnh và axit mạnh do đó hợp chất trung tính và khá bền. NaCl là muối trung hòa, là muối mà anion gốc Axit không có khả năng phân li ra ion H+.
- NaCl có pH bằng bao nhiêu? NaCl có pH = 7 vì nó là muối, và chính vì thế nó không làm đổi màu quỳ tím. Nếu có nhiều dung dịch khác nhau cần phân biệt bằng quỳ tím thì đây là một dữ kiện quan trọng giúp các bạn phân biệt được NaCl.
NaCl là liên kết gì?
- NaCl là liên kết ion hay liên kết điện tích, là một liên kết hóa học có bản chất là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu, ở đây là Na+ và Cl–. Liên kết ion được hình thành do lực hút tĩnh điện giữa kim loại điển hình và phi kim điển hình.
NaCl là chất điện li mạnh hay yếu?
- NaCl là chất điện ly mạnh, phân li hoàn toàn trong nước, tạo ra các ion âm và dương, là ion Na+ và Cl–. Nếu trong dung dịch có 99 phân tử NaCl hòa tan thì cả 99 phân tử đều phân li ra ion.
NaCl → Na+ + Cl–
- Các chất có tính điện li mạnh tương tự là các axit mạnh như HCl, HNO3, HClO4, H2SO4, HBr, HI,… các bazơ mạnh như KOH, NaOH, Ba(OH)2,… Và hầu hết các muối trừ HgCl2, Hg(CN)2.
NaCl có kết tủa không?
Khi cho HCl đặc vào dung dịch bão hòa Natri Clorua sẽ tạo thành kết tủa trắng. Khi thêm nước vào hỗn hợp này, kết tủa sẽ hòa tan lại.
Một số phản ứng tiêu biểu của NaCl
+ Phản ứng nhiệt phân NaCl tạo ra Na màu trắng và khí Clo màu vàng lục:
2NaCl → 2Na + Cl2
Khi tác dụng với Bạc Nitrat sẽ tạo ra 2 muối mới, trong đó có 1 muối tạo kết tủa trắng:
AgNO3 + NaCl → AgCl + NaNO3
Khi tác dụng với H2SO4 đậm đặc, trong điều kiện nhiệt độ rồi hấp thụ vào nước sẽ thu được axit mới là HCl:
H2SO4 + NaCl → HCl + NaHSO4
IV. Vậy muối tinh khiết công nghiệp được dùng để làm gì?
Trong công nghiệp, sản xuất
Trong công nghiệp, muối tinh khiết tiêu thụ hàng năm trên toàn thế giới khoảng 200 triệu tấn:
+ Đối với sản xuất da, giày: người ta dùng muối để bảo vệ da.
+ Trong sản xuất cao su: muối dùng để làm trắng các loại cao su.
+ Trong dầu khí: muối là thành phần quan trọng trong dung dịch khoan giếng khoan.
+ Từ muối có thể chế ra các loại hóa chất dùng cho các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javel,... bằng cách điện phân nóng chảy hoặc điện phân dung dịch NaCl có màng ngăn.
Trong nông nghiệp, trồng trọt
+ Trong chăn nuôi gia súc, gia cầm: muối dùng để cân bằng các quá trình sinh lý trong cơ thể giúp gia súc, gia cầm sẽ tăng trưởng nhanh, giảm bệnh tật.
+ Phân loại hạt giống theo trọng lượng.
+ Làm yếu tố vi lượng trộn với các loại phân hữu cơ để tăng hiệu quả phân bón.
Trong thực phẩm
+ Là thành phần chính trong muối ăn và được sử dụng phổ biến như là đồ gia vị và chất bảo quản thực phẩm với công dụng giúp thực phẩm không bị ươn, ôi trước khi thực phẩm được nấu.
+ Khử mùi thực phẩm, giữ cho trái cây không bị thâm.
+ Tăng hương vị, kiểm soát quá trình lên men của thực phẩm.
Trong y tế
+ Muối tinh khiết được dùng để sát trùng vết thương, trị cảm lạnh và dùng để pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh cho con người.
+ NaCl là một yếu tố thiết yếu đối với cuộc sống con người do thành phần chủ yếu của muối là natri và clo – hai nguyên tố đóng vai trò quan trọng trong việc cân bằng thể dịch trong cơ thể, đảm bảo cho các tế bào hoạt động bình thường.
+ Cung cấp muối khoáng cho cơ thể thiếu nước.
+ Muối có tác dụng khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, làm trắng răng, chữa hôi miệng,…
Trong đời sống gia đình
Trong đời sống gia đình, muối NaCl có rất nhiều ứng dụng mà không phải ai cũng biết hết.
+ Chăm sóc nhà cửa:
– Đuổi kiến
– Dập tắt lửa bùng cháy vì dầu mỡ
– Giữ nến khỏi chảy khi đốt
– Giữ cho hoa đã hái được tươi, hỗ trợ cắm hoa giả
– Sửa tường: Muốn bít các lỗ đinh hoặc vết lở trên tường thạch cao, lấy 2 muỗng muối và 2 muỗng bột bắp trộn với khoảng 5 muỗng nước.
– Giết cỏ dại
– Nướng thịt ngoài trời
+ Lau chùi:
– Giúp rửa sạch ống thoát bồn rửa chén bát
– Hỗ trợ tẩy vết trắng trên bàn gỗ để lại bởi ly nước và đĩa nóng, lau chùi chảo gang dính mỡ dễ dàng.
– Rửa tách trà hoặc cà-phê cáu bẩn. Đồng thời giúp rửa bình pha cả phê được sạch sẽ.
– Chùi sạch tủ lạnh, rỉ sét, đồng hồ hay đồng thau.
+ Giặt quần áo:
– tẩy vết rượu vang trên khăn bàn bằng bông hay vải sợi
– Gột rửa hết các vết dơ của mồ hôi, vết máu trên quần áo
– Làm sạch mặt bàn ủi
+ Chăm sóc cá nhân:
– Bảo trì bàn chải đánh răng
– Trị các bệnh về miệng
– Trị vết ong chích
– Trị vết muỗi cắn
– Xoa bóp sau khi tắm
– Trị viêm họng
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Phân biệt 5 dung dịch HCl, NaOH, NaSO4, NaCl, NaNO3. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









