Gốc axit mạnh
Gốc axit mạnh được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Gốc axit mạnh
Một số gốc axit mạnh
- HCl - axit clohydric
- HNO3 - axit nitric
- H2SO4 - axit sunfuric (HSO4 - là một axit yếu)
- HBr - axit hydrobromic
- HI - axit hydroiodic
- HClO4 - axit pecloric
- HClO3 - axit cloric
1. Gốc axit là gì?
- Axit là phân tử hóa học chúng gồm gốc axit và nguyên tử Hidro. Như vậy khi tách nguyên tử Hidro ra ta khỏi phân tử hóa học ta sẽ thu về gốc axit. Trên thực tế gốc axit tồn tại rất nhiều nơi, ngay cả trong thực phẩm hàng ngày như chanh, hoa quả,… Thậm chí là nước mà bạn đang uống hàng ngày chưa đi qua hệ thống lọc cũng chứa các gốc axit.
2. Cách xác định gốc axit mạnh
a) So sánh định tính tính axit của các axit
- Nguyên tắc chung: Nguyên tử H càng linh động thì tính axit càng mạnh.
- Đối với các axit có oxi của cùng một nguyên tố: càng nhiều O tính axit càng mạnh.
HClO < HClO2 < HClO3 < HClO4
- Đối với axit của các nguyên tố trong cùng chu kì: nguyên tố trung tâm có tính phi kim càng mạnh thì tính axit của axit càng mạnh (các nguyên tố đều ở mức hóa trị cao nhất).
H3PO4 < H2SO4 < HClO4
- Đối với axit của các nguyên tố trong cùng một nhóm A thì:
+ Axit không có oxi: tính axit tăng dần từ trên xuống dưới:
HF < HCl < HBr < HI (do bán kính ion X- tăng)
+ Axit có O: tính axit giảm dần từ trên xuống dưới:
HClO4 > HBrO4 > HIO4 (do độ âm điện của X giảm dần)
- Với các axit hữu cơ RCOOH: (nguyên tử H được coi không có khả năng hút hoặc đẩy e)
+ Nếu gốc R no (đẩy e) làm giảm tính axit. Gốc R no càng nhiều nguyên tử C thì khả năng đẩy e càng mạnh:
HCOOH > CH3COOH > CH3CH2COOH > CH3CH2CH2COOH > n-C4H9COOH.
+ Nếu gốc R hút e (không no, thơm hoặc có halogen...) sẽ làm tăng tính axit.
* Xét với gốc R có chứa nguyên tử halogen:
+ Halogen có độ âm điện càng lớn thì tính axit càng mạnh:
CH2FCOOH > CH2ClCOOH > CH2BrCOOH > CH2ICOOH > CH3COOH
+ Gốc R có chứa càng nhiều nguyên tử halogen thì tính axit càng mạnh:
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH > CH3COOH
+ Nguyên tử halogen càng nằm gần nhóm COOH thì tính axit càng mạnh:
CH3CH2CHClCOOH>CH3CHClCH2COOH>CH2ClCH2CH2COOH>CH3CH2CH2COOH
- Với một cặp axit/bazơ liên hợp: tính axit càng mạnh thì bazơ liên hợp của nó càng yếu và ngược lại.
- Với một phản ứng: axit mạnh đẩy được axit yếu khỏi dung dịch muối (trường hợp trừ một số đặc biệt).
b) So sánh định lượng tính axit của các axit
- Với axit HX trong nước có cân bằng:
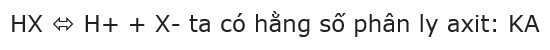
- KA chỉ phụ thuộc nhiệt độ, bản chất của axit. Giá trị của KA càng lớn tính axit của axit càng mạnh.
Tóm lược:
- Axit mạnh phân ly hoàn toàn thành ion của chúng trong nước, còn axit yếu chỉ phân ly một phần.
- Chỉ có một số (7) axit mạnh nên được nhiều người chọn học thuộc lòng. Tất cả các axit khác đều yếu.
- Các axit mạnh là axit clohydric, axit nitric, axit sunfuric, axit hydrobromic, axit hydroiodic, axit pecloric và axit cloric.
- Axit yếu duy nhất được tạo thành do phản ứng giữa hydro và halogen là axit flohidric (HF). Trong khi về mặt kỹ thuật là một axit yếu, axit flohydric cực kỳ mạnh và có tính ăn mòn cao.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Gốc axit mạnh. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









