Phenol tác dụng với Na?
Chúng tôi xin giới thiệu bài Phenol tác dụng với Na? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Phương trình phenol tác dụng với Natri?
Phương trình phenol tác dụng với Sodium?
|
2C6H5OH |
+ |
2Na |
→ |
2C6H5ONa |
+ |
H2 |
|
Phenol |
|
sodium |
|
Sodium phenolate |
|
Hydrogen |
|
Hydroxybenzene, |
|
|
|
Sodium phenolate |
|
Hydrogen |
|
(lỏng) |
|
(rắn) |
|
(lỏng) |
|
(khí) |
|
(không màu) |
|
(trắng) |
|
(không màu) |
|
(không màu) |
I. Phenol là gì?
Phenol là một hợp chất hữu cơ thơm có công thức phân tử là C6H5OH. Phân tử bao gồm một nhóm phenyl (−C6H5) liên kết với một nhóm hydroxyl (-OH)
Đây là một loại hóa chất độc hại, cấm dùng trong thực phẩm, có thể gây bỏng nặng nếu tiếp xúc với da.
Hơi có tính acid, nó đòi hỏi phải xử lý cẩn thận vì nó có thể gây bỏng nặng khi rơi vào da.
II. Tính chất vật lí
Phenol ít tan trong nước lạnh, tan nhiều trong nước nóng nên dùng để tách bằng phương pháp chiết.
Là chất rắn, độc, khi để lâu trong không khí bị chảy rữa do hút ẩm và chuyển thành màu hồng.
III. Tính chất hóa học
Do ảnh hưởng qua lại giữa nhóm – OH và vòng benzene, phenol có phản ứng thế nguyên tử H ở nhóm – OH (thể hiện tính acid) và phản ứng thế nguyên tử H của vòng benzene.
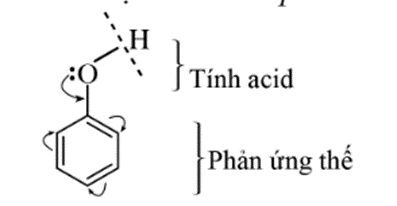
1. Tính acid của phenol
Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
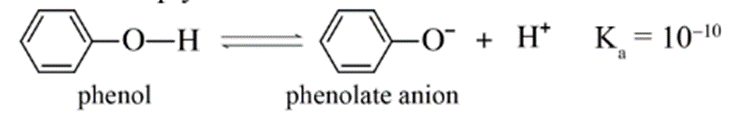
a) Phản ứng với dung dịch NaOH
Phenol ít tan trong nước, nhưng tan tốt trong dung dịch sodium hydroxide do có phản ứng: C6H5OH + NaOH → C6H5ONa + H2O.
b) Phản ứng với dung dịch sodium carbonat
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
Kết luận: Tính acid của phenol mạnh hơn tính acid của alcohol.
2. Phản ứng thế nguyên tử H của vòng benzene
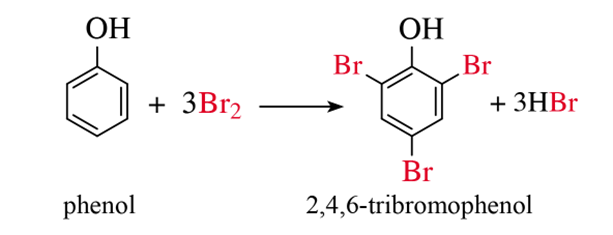
2.1. Phản ứng với nước bromine
- Nhỏ nước bromine vào dung dịch phenol, thấy xuất hiện kết tủa trắng.
Phương trình hoá học:
2.2.Phản ứng với dung dịch HNO3 đặc
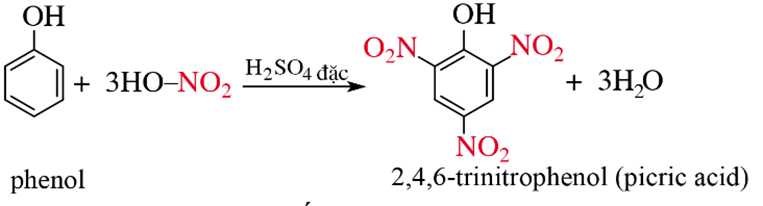
Kết luận: Phản ứng thế nguyên tử H của vòng benzene trong phân tử phenol xảy ra dễ hơn so với benzene.
III. Điều chế và ứng dụng
Điều chế
+ Trước kia người ta sản xuất phenol từ Chlorobenzen.
+ Phương pháp chủ yếu điều chế phenol trong công nghiệp hiện nay là sản xuất đồng thời phenol và axeton theo sơ đồ phản ứng sau:

Ngoài ra, phenol còn được tách từ nhựa than đá (sản phẩm phụ của quá trình luyện than cốc).
Ứng dụng
* Phần lớn phenol được dùng để sản xuất poliphenolfomanđehit (dùng làm chất dẻo, chất kết dính).
* Phenol được dùng để điều chế dược phẩm, phẩm nhuộm, thuốc nổ Picric acid (2,4,6-trinitrophenol), chất kích thích sinh trưởng thực vật, chất diệt cỏ 2, 4−D2, 4−D (2,4-Dichlorophenoxyacetic acid), chất diệt nấm mốc (nitrophenol), chất trừ sâu bọ,...
IV. Phenol có độc hại hay không?
Câu trả lời là có. Chúng là một hóa chất có tính rất độc hại, gây bỏng nặng khi rơi vào da.
Chúng và các dẫn xuất đều là các chất độc hại gây nguy hiểm cho sức khoẻ con người và mọi sinh vật sống.
Nó còn là chất gây ô nhiễm, có khả năng tích lũy trong cơ thể sinh vật và có khả năng gây nhiễm độc cấp tính, mãn tính cho con người.
Nếu như xâm nhập vào cơ thể, chúng sẽ gây ra rất nhiều tổn thương cho các cơ quan và hệ thống khác nhau, thế nhưng chủ yếu là tác động lên hệ thần kinh, hệ thống tim mạch và máu.
Liều nguy hiểm: từ 2 – 5gam. Liều gây chết người: trên 10gam.
-------------------------------------------









