Tính chất hóa học của nitơ
VnDoc xin giới thiệu bài Tính chất hóa học của nitơ được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Tính chất hóa học của nitơ
Câu hỏi: Tính chất hóa học của nitơ
Lời giải:
- Nitơ có các số oxi hóa: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
- Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
- Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
Tính oxi hóa: Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
Tác dụng với hidro
- Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
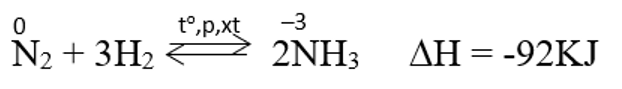
Tác dụng với kim loại
- Nhiệt độ thường, nitơ tác dụng với liti tạo thành liti nitrua:
6Li + N2 → 2Li3N.
- Ở nhiệt độ cao, nitơ tác dụng với Mg, tạo thành magie nitrua:
3Mg + N2 → Mg3N2
- Có 1 điểm cần chú ý là các nitrua rất dễ bị thủy phân tạo ra NH3. Nitơ chỉ thể hiện tính oxi hóa với những nguyên tố có độ âm điện nhỏ hơn.
Tính khử
- Khí nito thể hiện tính khử khi kết hợp cùng các nguyên tố có độ âm điện lớn hơn.
- Ở nhiệt độ khoảng 3000ºC, Nitơ tác dụng với oxi tạo nitơ monoxit
- Ở điều kiện thường, nitơ monoxit lại tác dụng với oxi có trong không khí, tạo thành nitơ đioxit đặc trưng với màu nâu đỏ.
– Một số oxit khác của nitơ gồm có N2O, N2O3, N2O5, nhưng không được điều chế trực tiếp từ oxi và nitơ.
I. Cấu tạo phân tử
- Nhóm VA có cấu hình electron ngoài cùng là: ns2np3.
- Nên vừa thể hiện được tính oxh và tính khử.
- Cấu hình electron của N2: 1s22s22p3.
- CTCT: N ≡ N.
- CTPT: N2.
- Số oxh của N2: -3, 0, +1, +2, +3, +4, +5.
II. Trạng thái tự nhiên
Trong tự nhiên, nito tồn tại ở dạng tự do và dạng hợp chất.
- Ở dạng tự do, nito chiếm 80% thể tích không khí.
- Ở dạng hợp chất, nito có nhiều trong khoáng vật NaNO3 có tên là diêm tiêu natri.
Ngoài ra nito có trong thành phần của protein, axit ucleic, … và nhiều hợp chất hữu khác.
III. Tính chất vật lý
- Tính chất vật lý của nito đầu tiên là chất khí không màu, không mùi, không vị, nhẹ hơn không khí với d = 28/29). Nó bị hóa lỏng ở -196ºC.
- Nitơ lỏng hay được gọi là được gọi bằng LN2, là cụm từ xuất hiện rộng rãi ngày nay, đặc biệt trong lĩnh vực y tế, bảo quản thực phẩm. Nó tồn tại trong một trạng thái lỏng ở nhiệt độ rất thấp, được tạo ra bằng cách chưng cất phân đoạn không khí lỏng. Một chất lỏng trong suốt, không màu, hằng số điện môi 1.4.
- Vậy khí nito có tan trong nước không, nó ít tan trong nước, hoá rắn ở nhiệt độ rất thấp.
- Nhiều người cũng thắc mắc khí nito có cháy không. Câu trả lời là không, khí N2 không duy trì sự cháy và sự hô hấp, nên không gây độc hại.
IV. Ứng dụng và điều chế
Ứng dụng
Ứng dụng trong bảo quản thực phẩm
- Bởi đặc tính trơ về mặt phản ứng, nên ngăn chặn được ảnh hưởng oxy hóa rất tốt. Vì vậy khí này có được ứng dụng trong việc bảo quản thực phẩm.
- Sử dụng để đóng gói hay dạng rời thực phẩm. Bằng cách làm chậm sự ô thiu và các dạng tổn thất khác gây ra bởi sự oxy hóa.
Ứng dụng của Khí N2 trong chùi rửa làm sạch
- Ngoài ra loại khí này còn được dùng trong việc chạy phân tích mẫu. Áp dụng trong việc hàn đường ống, cũng như chế tác các loại kim loại. Nâng cao được độ bền lâu chắc chắn hơn. Cách làm sạch đường ống này đảm bảo an toàn. Không làm hư hại tới các sản phẩm đang thực hiện để chế tác. Nên rất được ưa chuộng từ người sử dụng.
Ứng dụng trong việc luyện kim và chế tác kim loại
- Đối với các ngành luyện kim hay sản xuất các linh kiện điện tử, sản xuất thép không gỉ. Thường cần tới sự có mặt của khí nito để hỗ trợ sản xuất. Tùy thuộc vào đặc thù của công ty và nhu cầu sử dụng. Sẽ có lưu lượng và mức độ sử dụng lượng không khí này khác nhau.
Ứng dụng của Khí N2 Sử dụng trong việc bơm lốp ô tô và máy bay
- Với việc sở hữu được đặc tính trơ và thiếu các tính chất ẩm, đặc biệt oxy hóa cực thấp. Vì vậy mà nitơ được sử dụng rất nhiều trong việc bơm lốp ô tô hoặc máy bay.
Khí N2 Làm sạch để vận chuyển thực phẩm và các mẫu chế phẩm sinh học
- Khí nito cũng được sử dụng trong việc làm lạnh nhằm phục vụ việc vận chuyển thực phẩm. Một số đặc tính giúp làm lạnh an toàn mà không gây hại cho thực phẩm. Giúp ích cho việc bảo vệ các bộ phận thân thể. Cũng như đảm bảo cho các tế bào tinh trùng và trứng được bảo quản. Ứng dụng trong việc bảo vệ các mẫu và chế phẩm sinh học cơ thể người an toàn.
Ứng dụng của Khí N2 trong trong ngành giáo dục
- Nito là thành phần trong rất nhiều hợp chất. Vì vậy khí nito cũng được sử dụng trong bộ môn hóa học. Đảm bảo áp dụng nghiên cứu. Cũng như giáo dục cho các học sinh biết đặc tính của một số hợp chất.
- Ngoài ra khí này cũng có rất nhiều ứng dụng khác nhau trong đời sống. Đây được coi là một loại khí quan trọng với cơ thể sống.
V. Điều chế
Trong công nghiệp
- Chưng cất phân đoạn không khí lỏng, thu nitơ ở -196ºC, vận chuyển trong các bình thép, nén dưới áp suất 150 at.
Trong phòng thí nghiệm
- Đun dung dịch bão hòa muối amoni nitrit (Hỗn hợp NaNO2 và NH4Cl):
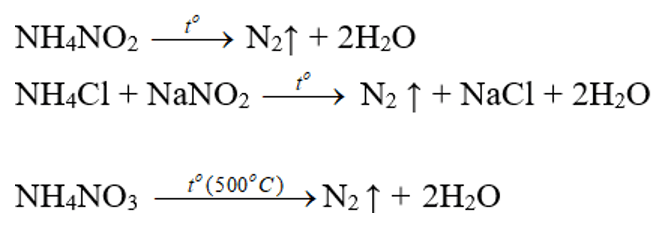
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Tính chất hóa học của nitơ. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










