Axit, bazo, muối - pH của dung dịch
Chuyên đề Hóa học lớp 11: Axit, bazo, muối - pH của dung dịch được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Axit, bazo, muối - pH của dung dịch
I. Axit, bazơ, muối
1. Axit và bazơ theo thuyết Areniut:
Axit: H2O → H+; Bazơ H2O → OH-
*Axit nhiều nấc:
VD: H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H+ + HPO42-
HPO42- ⇌ H+ + PO43-
* Bazơ nhiều nấc:
VD: Mg(OH)2 ⇌ Mg(OH)+ + OH-; Mg(OH)+ ⇌ Mg2+ + OH-
* Hiđroxit lưỡng tính:
A(OH)n : Zn(OH)2, Pb(OH)2, Sn(OH)2, Cu(OH)2, Al(OH)3, Cr(OH)3.
Phân li theo kiểu bazơ:
VD: Zn(OH)2 ⇌ Zn2+ + 2OH- ; Al(OH)3 ⇌ Al3+ + 3OH-
Phân li theo kiểu axit:
VD: Zn(OH)2 ⇌ ZnO22- + 2H+ ; Al(OH)3 ⇌ AlO2- + H3O+
2, Axit, bazơ theo Bronsted:
Axit là chất (hoặc ion) nhường proton H+.
Bazơ là chất (hoặc ion) nhận proton H+.
Chú ý:
Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4, ...) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb):
VD: CH3COOH ⇌ CH3COO- + H+
CH3COOH + H2O ⇌ CH3COO- + H+
VD: NH3 + H2O ⇌ NH4+ + OH-
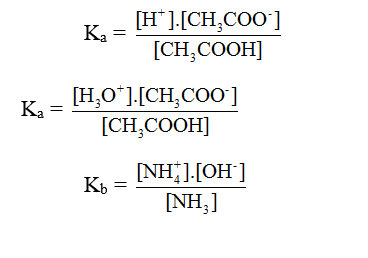
Sự điện li của muối trong nước:
VD: Na2SO4 → 2Na+ + SO42-
Muối axit, muối trung hoà:
+ Muối axit: Là muối mà gốc axit còn H có khả năng cho proton.
+ Muối trung hòa: Là muối mà gốc axit không còn H có khả năng cho proton.
II. pH của dung dịch
|
CÔNG THỨC |
MÔI TRƯỜNG |
|
pH = - lg[H+] pOH = - lg[OH-] [H+].[OH-] = 10-14 pH + pOH = 14 pH = a => [H+] = 10-a pOH = b => [OH+] = 10-b |
pH < 7 → Môi trường axit pH > 7 → Môi trường bazơ pH = 7 →Môi trường trung tính [H+] càng lớn ↔ Giá trị pH càng bé [OH-] càng lớn ↔ Giá trị pH càng lớn |
Trên đây VnDoc đã giới thiệu tới các bạn Axit, bazo, muối - pH của dung dịch. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 11, Giải bài tập Hóa học lớp 11, Giải bài tập Vật Lí 11, Tài liệu học tập lớp 11 mà VnDoc tổng hợp và đăng tải.









