Na2SO4 có kết tủa không?
Muối Sodium Sulphate
Na2SO4 có kết tủa không? nội dung tài liệu được VnDoc biên soạn ngoài việc giúp các bạn học sinh giải đáp thắc mắc liệu Na2SO4 có kết tủa không tài liệu còn hướng đến chi tiết tìm hiểu về muối Sodium Sulphate, về tính chất của Na2SO4, công thức cấu tạo Na2SO4 như thế nào?
1. Na2SO4 là chất gì?
Sodium Sulphate là một hợp chất muối trung hòa của natri được tạo thành bởi Sulfuric acid.
Công thức hóa học của Sodium Sulphate Na2SO4.
Sodium Sulphate tồn tại ở dạng khan được đặc trưng bởi tinh thể màu trắng và ngoài ra còn tồn tại dưới dạng ngậm nước là Na2SO4.10H2O
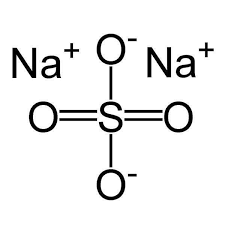
Công thức cấu tạo của Na2SO4
2. Tính chất của Na2SO4
Na2SO4 có màu trắng, không mùi và có vị đắng
Sodium sulphate có thể phản ứng với sulfuric acid tạo muối Sodium Bisulfate:
Na2SO4 + H2SO4 ⇌ 2NaHSO4
Na2SO4 có tính chất trao đổi ion
Cách tạo ra các sulfate không tan khi xử lý các dung dịch này với muối Ba2+ hay Pb2+:
Na2SO4 + BaCl2 → 2NaCl + BaSO4 (Kết tủa)
3. Na2SO4 có kết tủa không?
Không phải chất kết tủa
Phản ứng Na2SO4 với các muối BaCl2, Ba(NO3)2, hay base Ba(OH)2 sẽ tạo ra kết tủa trắng của BaSO4
Na2SO4 + Ba(NO3)2 → NaNO3 + BaSO4 ↓ trắng
4. Điều chế muối Sodium sulphate
- Na2SO4 được phòng thí nghiệm điều chế
Na2SO4 được tổng hợp từ phản ứng giữa sodium bicarbonate và magnesium sulfate.
2NaHCO3 + MgSO4 → Na2SO4 + Mg(OH)2 + 2CO2
- Điều chế trong công nghiệp như sau
2NaCl + H2SO4 → 2HCl + Na2SO4
Na2SO4 tồn tại ở dạng được 2NaOH + H2SO4 → Na2SO4 + 2H2O
5. Các chất kết tủa thường gặp và màu sắc của chúng
|
STT |
Chất kết tủa |
Màu sắc kết tủa |
STT |
Chất kết tủa |
Màu sắc kết tủa |
|
1 |
Al(OH)3 |
Keo trắng |
15 |
CaCO3 |
Trắng |
|
2 |
FeS |
Màu đen |
16 |
AgCl |
Trắng |
|
3 |
Fe(OH)2 |
Trắng xanh |
17 |
AgBr |
Vàng nhạt |
|
4 |
Fe(OH)3 |
Màu đỏ |
18 |
AgI |
Màu vàng cam hay vàng đậm |
|
5 |
FeCl2 |
Dung dịch màu lục nhạt |
19 |
Ag3PO4 |
Màu vàng |
|
6 |
FeCl3 |
Dung dịch màu vàng nâu |
20 |
Ag2SO4 |
Trắng |
|
7 |
Cu |
Màu đỏ |
21 |
MgCO3 |
Kết tủa trắng |
|
8 |
Cu(NO3)2 |
Dung dịch xanh lam |
22 |
CuS, FeS, Ag2S, PbS, HgS |
Màu đen |
|
9 |
CuCl2 |
Tinh thể màu nâu, dung dịch màu xanh lá cây |
23 |
BaSO4 |
Trắng |
|
10 |
Fe3O4 (rắn) |
Màu nâu đen |
24 |
BaCO3 |
Trắng |
|
11 |
CuSO4 |
Tinh thể khan có màu trắng, tinh thể ngậm nước và dung dịch màu xanh lam |
25 |
Mg(OH)2 |
Trắng |
|
12 |
Cu2O |
Có màu đỏ gạch |
26 |
PbI2 |
Vàng tươi |
|
13 |
Cu(OH)2 |
Màu xanh lơ (xanh da trời) |
27 |
C6H2Br3OH |
Trắng ngà |
|
14 |
CuO |
Màu đen |
28 |
Zn(OH)2 |
Keo trắng |
5. Câu hỏi vận dụng liên quan
Câu 1. Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2?
A. dung dịch HCl
B. dung dịch Pb(NO3)2
C. dung dịch Na2SO4
D. dung dịch NaCl
Thuốc thử dùng để phân biệt khí H2S với khí CO2 là dung dịch Pb(NO3)2 vì CO2 không tạo kết tủa với Pb(NO3)2
Câu 2. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Trường hợp không xảy ra phản ứng hóa học là:
B. FeCl2 + H2S → FeS + 2HCl
Vì FeS tan trong acid
Câu 3. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước bromine
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước bromine
A. O2, nước bromine, dung dịch KMnO4.
Đúng vì SO2 là chất khử ( có số OXH tăng từ +4 lên +6)
B. Dung dịch NaOH, O2, dung dịch KMnO4.
Sai.Vì NaOH không thể tính tính oxh hoặc khử khi tác dụng với SO2
C. Dung dịch Ba(OH)2, H2S, nước bromine.
Sai. Vì có Ba(OH)2
D. H2S, O2, nước brom.
Câu 4. Cho các nhận định sau:
(a) Sự điện li của chất điện li yếu là thuận nghịch.
(b) Chỉ có hợp chất ion mới có thể điện li được trong nước.
(c) Chất điện li phân li thành ion khi tan vào nước hoặc tại trạng thái nóng chảy.
(d) Nước là dung môi phân cực, có vai trò quan trọng trong quá trình điện li.
(e) Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra các chất.
Số nhận định đúng là:
A. 1
B. 2
C. 3
D. 4
(a) Sự điện li của chất điện li yếu là thuận nghịch.
(c) Chất điện li phân li thành ion khi tan vào nước hoặc tại trạng thái nóng chảy.
(d) Nước là dung môi phân cực, có vai trò quan trọng trong quá trình điện li.
Câu 5. Dãy chất nào sau đây gồm toàn muối không tan trong nước
A. Na2SO3, Al2(SO4)3, KHSO4, Na2S
B. KCl, Ba(NO3)2, CuCl2, Ca(HCO3)2
C. ZnCl2, Mg(NO3)2, KCl, K2S
D. BaSO4, AgCl, CaCO3, Ca3(PO4)2
BaSO4, AgCl, CaCO3, Ca3(PO4)2 đều là các kết tủa không tan được trong nước.
......................................



