Tổng hợp kiến thức Hóa 11 học kì 2 Hay Chi tiết
Tóm tắt kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức hóa 11 học kì 2 Hay Chi tiết được VnDoc tổng hợp sưu tầm, là trọng tâm toàn bộ kiến thức đã được học trong chương trình kì 2 Hóa 11. Mời các bạn cùng theo dõi bài viết dưới đây nhé.
A. Tài liệu ôn tập Học kì 2 Hóa 11
- Bài tập lập công thức phân tử hợp chất hữu cơ
- Công thức tính nhanh số đồng phân
- Bảng nhận biết các chất hữu cơ
- Đề cương ôn tập hóa 11 học kì 2 Có đáp án
B. Đề kiểm tra Hóa 11 học kì 2 có đáp án tham khảo
- 10 đề thi học kì 2 môn Hóa 11 - Ban cơ bản Có đáp án
- Đề thi Hóa học kì 2 lớp 11 năm 2021 - Đề số 2
- 5 đề kiểm tra học kì 2 lớp 11 môn Hóa học
C. Tóm tắt lý thuyêt Hóa 11 học kì 2
CHƯƠNG V: HYDROCACBON NO
Hidrocacbon no là hidrocacbon mà trong phân tử chỉ chứa liên kết đơn, các nguyên tử cacbon đều ở trạng thái lai hóa sp3, cấu trúc tứ diện.
Bài 23: Ankan
I. Đồng đẳng, đồng phân, danh pháp AnKan
Ankan (hay parafin) là những hidrocacbon no, mạch hở.
1. Đồng đẳng:
Ankan đơn giản nhất là metan CH4
| Tên gọi | Công thức | Nhiệt độ sôi (oC) | Tên gọi | Công thức | Nhiệt độ sôi (oC) |
| Metan | CH4 | -162 | Hexen | C6H14 | +69 |
| Etan | C2H6 | -80 | Heptan | C7H16 | +98 |
| Propan | C3H8 | -42 | Octan | C8H18 | +126 |
| Butan | C4H10 | -0,5 | Nonan | C9H20 | +151 |
| Pentan | C5H12 | +36 |
Công thức tổng quát: CnH2n+2 (n≥1)
Chứng minh:
Gọi n là số nguyên tử C trong phân tử ankan → có (n-1) liên kết đơn C-C trong phân tử
Mỗi C có 4 electron hóa trị → nC có 4n electron hóa trị, mà mỗi liên kết C-C sử dụng hết 2 electron hóa trị → số electron sử dụng vào liên kết C-C là 2.(n-1) electron.
Số elctron hóa trị còn lại của các nguyên tử C dùng để liên kết với H là:
4n - 2.(n-1) = 2n+1 bằng chính số nguyên tử H.
Công thức chung của ankan CnH2n+ 2
2. Đồng phân
Các ankan có đồng phân mạch cacbon
Ví dụ: CH4, C2H6, C3H8 chỉ có một đồng phân
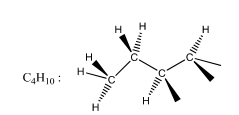
C4H10: có 2 đồng phân
H3C-CH2-CH2-CH3
H3C-CH(CH3)-CH3
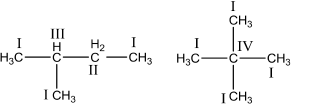
Bậc của một nguyên tử C là số C liên kết trực tiếp với nó
Ankan mà phân tử chỉ chứa C bậc I và C bậc II (không chứa C bậc III và C bậc IC) là ankan không phân nhánh
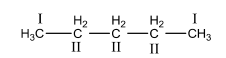
Ankan mà phân tử có chứa C bậc III hoặc C bậc IV là ankan phân nhánh
3. Danh pháp
Tên gọi của tất cả các ankan trong dãy đồng đằng đều tận cùng bằng an.
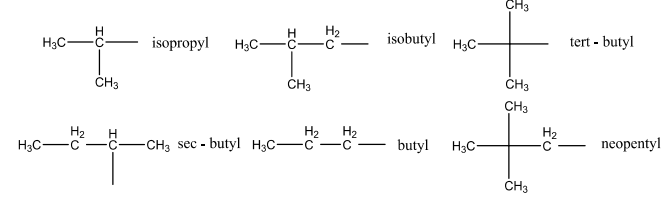
Tên gọi của gốc hidirocacbon tương tự tên của ankan tương ứng, chỉ đổi đuôi an thành đuôi yl
Ví dụ: -CH3 (metyl), C2H5 (etyl), -C3H7(propyl)...
Một số gốac ankyl thường gặp
3.1 Tên thường
Cân nhớ:
| Số C | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Tên mạch chính | met | et | Prop | but | pent | hex | hept | oct | non | dec |
AnKan mạch thẳng: thêm tiền tố n-
Ví dụ: CH3-CH2-CH2-CH3: n-butan
CH3-CH2-CH2-CH2-CH3: n-pentan
Ankan có 1 nhánh - CH3 ở C gần cuối mạch: thêm tiền tố iso-
AnKan có 2 nhánh -CH3 ở C gần cuối mạch: thêm tiền tố neo-
3.2 Tên quốc tế
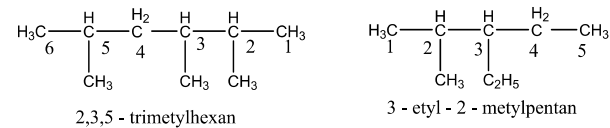
Chọn mạch C dài nhất làm mạch chính.
Đánh số thứ tự các nguyên tử C trong mạch chính, bắt đầu từ mạch gần nhánh hơn.
Tên ankan = vị trí nhóm thế + tên nhóm thế + tên mạch chính.
Các bước gọi tên:
Bước 1: Chọn mạch dài nhất chứa nhiều nhất làm mạch chính
Bước 2: Đánh số C trên mạch chính sao cho tổng số vị trí nhánh là nhỏ nhất
Bước 3: Đọc tên nhánh theo thứ tự chữu cái, nếu có nhiều nhánh giống nhau ta thêm tiếp đầu ngữ đi (2), tri(3), tetra (4). penta (5),...
II. Cấu trúc phân tử Ankan
Sự hình thành liên kết trong phân tử ankan
Các nguyên tử C ankan đều ở trạng thái lai hóa sp3
Mỗi nguyên tửu C nằm trên đỉnh tứ diện đều mà 4 đỉnh là các nguyên tửu H hoặc C.
Hóa trị của C hầu như đã bão hòa.
2. Cấu trúc không gian của ankan
2.1 Mô hình phân tử
Mô hình rỗng

CH3-CH2-CH3
Mô hình đặc
2.2. Cấu trạng
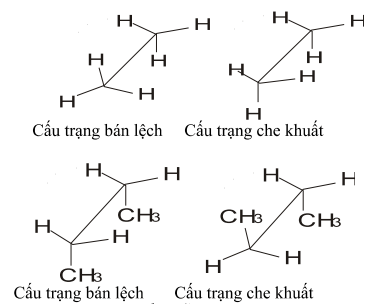
Công thức của ankan biểu diễn trong không gian: phải được biếu diễn đúng trạng thái lai hóa, tại mỗi cacbon các liên kết đơn phải tạo được hình tứ diện:
Ví dụ
 |
Gạch thằng nằm cùng mặt phẳng Gạch nối hướng ra xa mặt phẳng Gạch nét đam hướng vào mắt người |
III. Tính chất vật lí
Ở điều kiện thường bốn ankan đầu tiên trong dãy đồng đẳng: CH4, C2H6, C3H8, C4H10 là những chất khí. Các ankan tiếp theo là chất lỏng hoặc rắn:
5 ≤ n ≤ 16: chất lỏng
n ≥ 17: chất rắn
Mạch cacbon càng phân nhánh làm bề mặt tiếp xúc giảm dẫn đến lực Van der Walls giảm làm cho nhiệt độ sôi giảm
Tất cả các ankan đều hầu như không tan trong nước vì không có liên kết hidrogen giữa ankan với nước, nhưng tan được trong dung môi hữu cơ, benzen,... Vì ankan (lỏng) là những dung môi không phân cực nên hòa tan được những chất không phân cực.
Ankan là những chất không màu.
IV. Tính chất hóa học
Phản ứng thế halogen (ưu tiên thế H ở nguyên tử C bậc cao)
Tổng quát:
CnH2n+2 + kX2 ![]() \(\overset{as}{\rightarrow}\) CnH2n+2-kXk + kHX
\(\overset{as}{\rightarrow}\) CnH2n+2-kXk + kHX
Ví dụ:
CH4 + Cl2 ![]() \(\overset{as}{\rightarrow}\) CH3Cl (clometan) + HCl
\(\overset{as}{\rightarrow}\) CH3Cl (clometan) + HCl
CH3Cl + Cl2 ![]() \(\overset{as}{\rightarrow}\) CH2Cl2 (điclometan) + HCl
\(\overset{as}{\rightarrow}\) CH2Cl2 (điclometan) + HCl
CH2Cl2 + Cl2 ![]() \(\overset{as}{\rightarrow}\) CHCl3 (triclometan) + HCl
\(\overset{as}{\rightarrow}\) CHCl3 (triclometan) + HCl
CHCl3 + Cl2 ![]() \(\overset{as}{\rightarrow}\) CCl4 + HCl
\(\overset{as}{\rightarrow}\) CCl4 + HCl
C2H6 + Cl2 ![]() \(\overset{as}{\rightarrow}\) C2H5Cl + hCl
\(\overset{as}{\rightarrow}\) C2H5Cl + hCl
Khả năng phản ứng của halogen theo thứ tự: F> Cl> Br> I
Để xem toàn bộ Tổng hợp kiến thức hóa 11 học kì 2 mời các bạn ấn link TẢI VỀ bên dưới
.........................



