Đề thi học sinh giỏi cấp cơ sở tỉnh Điện Biên năm 2013 môn Hóa lớp 11 - Có đáp án
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
KÌ THI CHỌN HỌC SINH GIỎI CẤP CƠ SỞ
|
MÔN THI: HÓA HỌC - LỚP 11
Thời gian làm bài: 180 phút (không kể thời gian giao đề)
--------------------------------------------------------------------------------
Câu 1 (4,5 điểm)
1.Viết các phương trình hóa học theo sơ đồ sau (ghi rõ điều kiện phản ứng, nếu có)
![]()
2. A là một ancol no mạch hở. Đốt cháy hoàn toàn m gam A, thu được 3,36 lít khí CO2 (đktc) và 3,6 gam nước. Xác định công thức phân tử, viết các công thức cấu tạo của A và ghi tên thay thế.
3. Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,16M, thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,16M và Ba(OH)2 a M vào dung dịch X, thu được 3,94 gam kết tủa và dung dịch Z. Tính giá trị của a.
Câu 2 (4,0 điểm)
1. A là một đồng đẳng của benzen có tỷ khối hơi so với metan bằng 5,75. A tham gia chuyển hóa theo sơ đồ
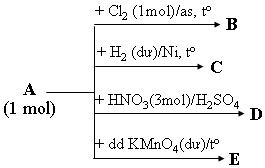
Hãy viết các phương trình hóa học theo sơ đồ trên, các chất hữu cơ viết dạng công thức cấu tạo rút gọn, cho biết B, C, D, E là các chất hữu cơ.
2. Hỗn hợp khí X gồm metan, axetilen, propen. Đốt cháy hoàn toàn 5,5 gam hỗn hợp X, thu được 6,3 gam nước. Mặt khác, lấy 5,5 gam X cho tác dụng với dung dịch AgNO3 trong NH3 dư, thu được 24 gam kết tủa. Hãy xác định phần trăm theo thể tích từng chất trong X.
Câu 3 (4,0 điểm)
1. Nêu hiện tượng và viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Cho đồng kim loại vào dung dịch hỗn hợp NaNO3 và H¬2SO4 loãng.
b) Sục khí NH3 đến dư vào dung dịch MgCl2.
c) Cho (NH4)2CO3 vào dung dịch Ba(OH)2.
d) Hai lọ hóa chất mở nắp để cạnh nhau: một lọ đựng dung dịch NH3 đậm đặc, một lọ đựng dung dịch HCl đặc.
2. Dung dịch A chứa Na2CO3 0,1M và NaHCO3 0,1M; dung dịch B chứa KHCO3 0,1M
a) Tính thể tích khí CO2 (đktc) thoát ra khi cho từ từ từng giọt đến hết 150 ml dung dịch HCl 0,1M vào 100 ml dung dịch A.
b) Xác định số mol các chất có trong dung dịch thu được khi thêm 100 ml dung dịch Ba(OH)2 0,1M vào 150 ml dung dịch B.
Câu 4 (3,5 điểm)
1. Cho 200 ml dung dịch X chứa H2SO4 0,05M và HCl 0,1M tác dụng với 300 ml dung dịch Y chứa Ba(OH)2 a M và KOH 0,05M, thu được m gam kết tủa và 500 ml dung dịch Z có pH = 12. Tính giá trị của m và a.
2. Hỗn hợp A gồm Mg, Al, Zn. Hòa tan hoàn toàn 7,5 gam A trong dung dịch HNO3, sau khi phản ứng kết thúc thu được dung dịch B và 1,12 lít hỗn hợp khí NO và N2O có số mol bằng nhau. Cô cạn dung dịch B thu được 31,75 gam muối.
Tính thể tích dung dịch HNO3 0,5 M tối thiểu để hòa tan hoàn toàn A.
Câu 5 (2,0 điểm)
Chia 2,24 lít (đktc) hỗn hợp X gồm hai anken phân tử khác nhau 2 nhóm CH2 thành hai phần bằng nhau.
Phần 1: Đốt cháy hoàn toàn rồi cho sản phẩm cháy qua dung dịch Ca(OH)2 dư, thu được 12,5 gam kết tủa.
Phần 2: Cho tác dụng hoàn toàn với nước có xúc tác thu được hỗn hợp chỉ gồm 2 ancol. Đun nóng hỗn hợp 2 ancol với H2SO4 đặc ở 1400C một thời gian, thu được 1,63 gam hỗn hợp 3 ete. Hoá hơi lượng ete thu được 0,4256 lít (đktc).
a) Xác định công thức cấu tạo của hai anken và tính phần trăm theo thể tích mỗi chất trong X.
b) Xác định hiệu suất tạo ete của mỗi ancol.
Câu 6 (2,0 điểm)
1. Cho pin điện hóa: H2(Pt), PH2 = 1atm/H+:1M || MnO-4:1M, Mn2+:1M, H+:1M/Pt
Biết rằng sức điện động của pin ở 250C là 1,5V.
a) Hãy cho biết phản ứng thực tế xảy ra trong pin và tính ![]()
b) Sức điện động của pin thay đổi như thế nào khi thêm một ít NaHCO3 vào nửa trái của pin.
2. Ion Fe3+(dd) là axit, phản ứng với nước theo cân bằng
a) Xác định pH của dung dịch FeCl3 .
b) Tính nồng độ mol/lít của dung dịch FeCl3 bắt đầu gây ra kết tủa Fe(OH)3 và tính pH của dung dịch lúc bắt đầu kết tủa. Cho TFe(OH)3 = 10-38; KH2O = 10-2,2.
Cho: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; Ca = 40; Ba = 137; Fe = 56; Cu = 64; Zn = 65; Ag =108.



