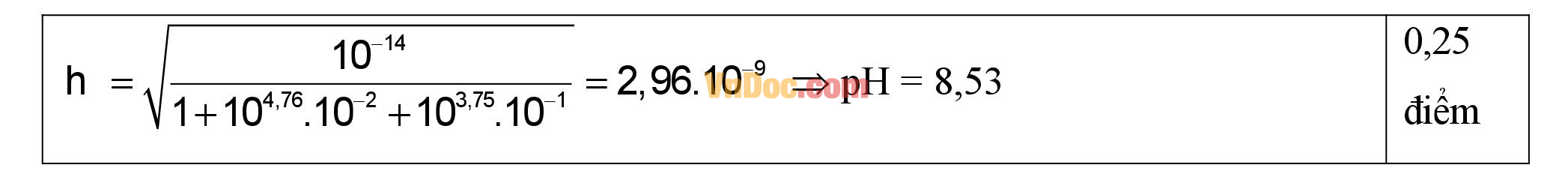Đề thi học sinh giỏi môn Hóa học lớp 12 tỉnh Quảng Bình năm học 2015 - 2016
Đề thi học sinh giỏi cấp tỉnh môn Hóa học lớp 12
Đề thi học sinh giỏi môn Hóa học lớp 12 tỉnh Quảng Bình năm học 2015 - 2016. Đây là tài liệu hay dành cho các bạn học sinh đang trong quá trình ôn thi học sinh hỏi cấp tỉnh. Với đề thi này kỹ năng giải đề của các bạn sẽ được nâng cao. Mời các bạn tham khảo.
Đề thi học sinh giỏi môn Hóa học lớp 12 tỉnh Quảng Trị năm học 2015 - 2016
Đề thi chọn học sinh giỏi cấp tỉnh môn Hóa học lớp 12 Chuyên Sở GD - ĐT Bắc Ninh năm 2015 - 2016
| SỞ GD&ĐT QUẢNG BÌNH ĐỀ THI CHÍNH THỨC Họ và tên:....................... |
KỲ THI CHỌN HSG TỈNH NĂM HỌC 2015 - 2016 Khóa ngày 23/03/2016 Môn: HÓA HỌC LỚP 12 THPT Thời gian làm bài: 180 phút (không kể thời gian giao đề) Đề gồm có 02 trang |
Câu 1 (2,0 điểm)
1. Hoàn thành phương trình hóa học của các phản ứng sau:
a) CuSO4 + NaI → b) Sn + H2SO4 (đặc) ![]()
c) CrCl3 + Cl2 + NaOH → d) NaHCO3 + Ca(OH)2 ![]()
e) Fe(OH)3 + HI → f) CrCl3 + Zn(dư) →
g) Na2O2 + CO2 → h) Al4C3 + KOH + H2O →
2. Viết phương trình hóa học xảy ra trong các trường hợp sau:
a) H2NCH2COONa + HCl (dư) → b) anilin + NaNO2 + HCl ![]()
c) Axit glutamic + NaOH (dư) → d) Glucozơ + nước brom →
e) CH3COOCHCl-CH3 + NaOH (dư) ![]() f) CH3-CH=CH2 + HBr (khí)
f) CH3-CH=CH2 + HBr (khí) ![]()
g) Vinyl fomat + Cu(OH)2 + NaOH (dư) ![]()
Câu 2 (2,5 điểm)
1. Cho sơ đồ phản ứng sau:
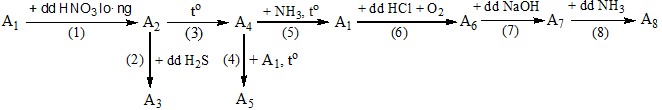
Viết phương trình hóa học của các phản ứng xảy ra theo sơ đồ chuyển hóa trên. Biết các chất từ A1 đến A8 là đồng và các hợp chất của đồng.
2. Giải thích tại sao chì không tan trong dung dịch axit sunfuric loãng nhưng tan trong dung dịch axit sunfuric đặc, nóng.
3. Axit salixilic (axit o-hiđroxibenzoic) tác dụng với metanol (có mặt H2SO4 đặc, xúc tác) tạo thành metyl salixilat; axit salixilic tác dụng với anhiđrit axetic tạo thành axit axetyl salixilic. Cho metyl salixilat và axit axetyl salixilic lần lượt tác dụng với dung dịch NaOH dư, đun nóng.
Viết phương trình hóa học của các phản ứng xảy ra.
Câu 3 (2,0 điểm)
1. Khi thực hiện phản ứng este hoá 1 mol CH3COOH và 1 mol C2H5OH, lượng este lớn nhất thu được là 2/3 mol. Để đạt hiệu suất cực đại là 90% khi tiến hành este hoá 1 mol CH3COOH cần bao nhiêu mol C2H5OH?
Biết các phản ứng este hoá thực hiện ở cùng nhiệt độ.
2. Hấp thụ hoàn toàn 112 ml khí SO2 (đktc) cần dùng vừa đủ V lít dung dịch KMnO4 0,002M, thu được dung dịch X.
a) Viết phương trình hóa học ở dạng phân tử của phản ứng xảy ra và xác định giá trị của V.
b) Tính pH của dung dịch X. Biết ![]()
Câu 4 (1,75 điểm)
1. Ðun nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 600 ml dung dịch NaOH 1,15M, thu được dung dịch Y chứa muối của một axit cacboxylic đơn chức và 15,4 gam hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 5,04 lít khí H2 (đktc). Cô cạn dung dịch Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 7,2 gam một chất khí. Xác định giá trị của m.
2. Muối KClO4 được điều chế bằng cách điện phân dung dịch KClO3. Thực tế khi điện phân ở một điện cực, ngoài nửa phản ứng tạo ra sản phẩm chính là còn đồng thời xảy ra nửa phản ứng phụ tạo thành một khí không màu. Ở điện cực thứ hai chỉ xảy ra nửa phản ứng tạo ra một khí duy nhất. Hiệu suất tạo thành sản phẩm chính chỉ đạt 60%.
a) Viết các nửa phản ứng ở anot và catot.
b) Tính thể tích khí thoát ra ở catot, anot (đo ở đktc) khi điều chế được 332,4 gam KClO4.
Câu 5 (1,75 điểm)
1. Sắp xếp (có giải thích) trình tự tăng dần tính axit của các chất sau: (CH3)3Si-CH2-COOH; (CH3)3C-CH2-COOH; (CH3)3N+-CH2-COOH
2. Đun nóng vài giọt clorofom với lượng dư dung dịch NaOH, sau đó nhỏ thêm vài giọt dung dịch KMnO4 thấy hỗn hợp xuất hiện màu xanh. Viết phương trình hóa học của các phản ứng xảy ra.
3. Trộn 15 ml dung dịch CH3COONa 0,03M với 30 ml dung dịch HCOONa 0,15M. Tính pH của dung dịch thu được.
Biết pKa (CH3COOH) = 4,76 và pKa (HCOOH) = 3,75.
Cho: H = 1; C = 12; O = 16; Na = 23; Cl = 35,5; K = 39
ĐÁP ÁN ĐỀ THI HSG CẤP TỈNH MÔN HÓA HỌC LỚP 12