Đề thi học sinh giỏi môn Hóa học lớp 12 trường THPT Cẩm Thủy 1, Thanh Hóa năm học 2015 - 2016 (Vòng 2)
Đề thi học sinh giỏi môn Hóa học lớp 12
Đề thi học sinh giỏi môn Hóa học lớp 12 trường THPT Cẩm Thủy 1, Thanh Hóa năm học 2015 - 2016 (Vòng 2) là đề kiểm tra khảo sát chất lượng ôn thi của đội tuyển học sinh giỏi lớp 12 môn Hóa. Đề thi có đáp án đi kèm, hi vọng sẽ giúp các bạn luyện tập và củng cố kiến thức, bồi dưỡng học sinh giỏi môn Hóa hiệu quả hơn. Mời các bạn tham khảo.
Đề thi học sinh giỏi thành phố lớp 12 môn Hóa (2011 - 2012)
Đề thi học sinh giỏi tỉnh Nghệ An năm 2012 - 2013 môn Hóa lớp 12 Bảng A (Có đáp án)
|
TRƯỜNG THPT CẨM THỦY 1 ĐỘI TUYỂN HÓA HỌC
ĐỀ CHÍNH THỨC |
KHẢO SÁT HỌC SINH GIỎI CẤP TỈNH (Vòng 2) Năm học: 2015-2016 Môn thi: HÓA HỌC. Lớp 12 -THPT Ngày thi: 25/02/2016 Thời gian: 180 phút (không kể thời gian giao đề) |
Câu 1. (2,0 điểm). Tổng số hạt proton, nơtron, electron trong nguyên tử của 2 nguyên tố M và X lần lượt là 82 và 52. M và X tạo thành hợp chất MXa (a: nguyên dương, trong hợp chất MXa thì X có số oxi hóa bằng -1), trong phân tử của hợp chất MXa có tổng số hạt proton bằng 77. Xác định công thức phân tử MXa.
(Cho biết một số nguyên tố: 7N, 8O, 9F, 16S, 15P, 17Cl, 29Cu, 26Fe, 30Zn, 24Cr, 25Mn)
Câu 2. (2,0 điểm).
1. Viết phương trình hóa học của các phản ứng xảy ra khi cho dung dịch NaOH, dung dịch NH3, khí Cl2, bột Mg, dung dịch HNO3 (tạo khí NO duy nhất) lần lượt tác dụng với dung dịch Fe(NO3)2.
2. Hoàn thành các phương trình hoá học theo sơ đồ chuyển hoá sau (Ghi rõ điều kiện phản ứng, các chất viết ở dạng công thức cấu tạo thu gọn).
C8H14O4 + NaOH→ X1 + X2 + H2O
X1 + H2SO4 → X3 + Na2SO4
X3 + X4 → nilon-6,6 + H2O
X2 + X3 → X5 + H2O (tỷ lệ số mol X2: số mol X3 = 2:1)
Câu 3. (2,0 điểm).
1. Hoà tan Al trong dung dịch HNO3 loãng, dư được dung dịch D và khí E không màu, không hoá nâu ngoài không khí và được điều chế bằng đun nóng dung dịch bão hoà NH4NO2. Chia dung dịch D làm 2 phần:
- Nhỏ từ từ dung dịch NH3 đến dư vào phần thứ nhất
- Nhỏ từ từ dung dịch NaOH đến dư vào phần thứ hai, thấy có khí thoát ra.
Viết phương trình hoá học của các phản ứng xảy ra.
2. Một hợp chất hữu cơ (A) có công thức phân tử là C2H6O2 và chỉ có một loại nhóm chức. Từ (A) và các chất vô cơ khác, bằng 3 phản ứng liên tiếp có thể điều chế được cao su buna. Xác định công thức cấu tạo có thể có của (A) và viết PTHH của các phản ứng.
Câu 4: (2,0 điểm). Cho 23,52g hỗn hợp 3 kim loại Mg, Fe, Cu vào 200ml dung dịch HNO3 3,4M khuấy đều thấy thoát ra một khí không màu hóa nâu trong không khí (sản phẩm khử duy nhất), trong dung dịch còn dư một kim loại chưa tan hết. Cho tiếp từ từ dung dịch H2SO4 5M vào, chất khí trên lại thoát ra cho đến khi kim loại vừa tan hết thì mất đúng 44ml, thu được dung dịch A. Cho dung dịch NaOH dư vào dung dịch A, lọc kết tủa, rửa rồi nung ngoài không khí đến khối lượng không đổi thu được chất rắn B nặng 31,2 g. Biết các phản ứng xảy ra hoàn toàn.
- Tính % số mol mỗi kim loại trong hỗn hợp đầu.
- Tính nồng độ mol/l các ion trong dung dịch A.
Câu 5. (2,0 điểm).
- Thêm 100ml dung dịch có pH = 2 (gồm HCl và HNO3) vào 100ml dung dịch NaOH 0,1M. Tính pH của dung dịch thu được.
- Trộn 100ml dung dịch Al2(SO4)3 1M với Vml dung dịch NaOH 4M thu được 11,7 gam kết tủa. Xác định V.
- Cho 19,52 gam hỗn hợp bột A gồm Fe và Cu vào dung dịch HNO3, khuấy đều đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí NO (sản phẩm khử duy nhất, đktc), 400ml dung dịch B và còn lại 1,92 gam một kim loại. Xác định nồng độ mol/l của các chất tan trong dung dịch B.
Câu 6. (2,0 điểm).
- Một hiđrocacbon X có chứa 88,235% cacbon về khối lượng. Xác định công thức phân tử
- Cho 5 kg glucozơ (chứa 20% tạp chất) lên men. Hãy tính thể tích của ancol etylic 400 thu được, biết rằng khối lượng ancol bị hao hụt 10% và khối lượng riêng của ancol etylic nguyên chất là 0,8 g/ml.
Câu 7. (2,0 điểm).
- Hợp chất hữu cơ A mạch hở (phân tử chỉ chứa C, H, O; MA < 78). A tác dụng được với dung dịch NaOH. Đốt cháy hoàn toàn 8,64 gam A rồi cho toàn bộ sản phẩm cháy lần lượt đi qua bình 1 chứa dung dịch H2SO4 đặc; bình 2 chứa dung dịch Ba(OH)2 dư thấy khối lượng bình 1 tăng 4,32 gam, bình 2 xuất hiện 70,92 gam kết tủa. Xác định công thức phân tử, công thức cấu tạo, gọi tên A.
- Chia 14,2 gam hỗn hợp X gồm hai anđehit đơn chức thành hai phần bằng nhau. Đốt cháy hoàn toàn phần 1 thu được 15,4 gam CO2 và 4,5 gam H2O. Cho phần 2 tác dụng với lượng dư dung dịch AgNO3 trong NH3 thu được 43,2 gam bạc. Xác định công thức cấu tạo của hai anđehit trên.
Câu 8. (2,0 điểm). Cho 20,8 gam hỗn hợp Fe, FeS, FeS2, S tác dụng với dung dịch HNO3 đặc nóng dư thu được V lít khí NO2 (là sản phẩm khử duy nhất, đo ở đktc) và dung dịch A. Cho A tác dụng với dung dịch Ba(OH)2 dư thu được 91,3 gam kết tủa. Tính V?
Câu 9. (2,0 điểm). Hợp chất A có công thức C9H8 có khả năng kết tủa với dung dịch AgNO3 trong NH3 và phản ứng với brom trong CCl4 theo tỷ lệ mol 1:2. Đun nóng A với dung dịch KMnO4 tới khi hết màu tím, rồi thêm lượng dư dung dịch HCl đặc vào hỗn hợp sau phản ứng thấy có kết tủa trắng là axit benzoic đồng thời giải phóng khí CO2 và Cl2. Xác định công thức cấu tạo của A và viết phương trình hóa học của các phản ứng xẩy ra.
Câu 10. (2,0 điểm).
- Chỉ dùng dung dịch Ba(OH)2, hãy trình bày phương pháp hóa học nhận biết các dung dịch riêng biệt sau: (NH4)2SO4, NH4Cl, NaCl, MgCl2, AlCl3. Viết phương trình hóa học của các phản ứng xảy ra.
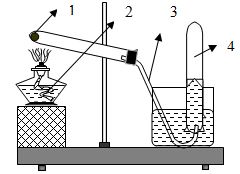
- Cho hình vẽ sau mô tả quá trình điều chế ôxi trong phòng thí nghiệm. Hãy cho biết tên dụng cụ và hóa chất theo thứ tự 1, 2, 3, 4 trên hình vẽ đã cho. Viết phản ứng hóa học.
Cho biết: H =1; C = 12; N = 14; O = 16; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Ag = 108; Ba = 137.
Đáp án đề thi học sinh giỏi môn Hóa học lớp 12
Câu 1. (2,0 điểm).
Gọi p, n, e là số hạt cơ bản của X (p, n, e nguyên dương)
Có: 2p + n = 52 → n = 52 -2p
Ta luôn có p ≤ n ≤ 1,524p → p ≤ 52-2p ≤ 1,524p → 14,75 ≤ p ≤ 17,33.
Vì p nguyên p = 15, 16, 17.
Cấu hình electron của X là: p = 15: 1s22s22p63s23p3
p = 16: 1s22s22p63s23p4
p = 17: 1s22s22p63s23p5
Trong hợp chất X có số oxi hóa bằng -1 => X là Cl
Vậy X có 17p, 17e, 18n X là Clo (Cl)
Gọi p'; n'; e' là số hạt cơ bản của M.
Tương tự ta có n' = 82-2p' → 3p' ≤ 82 ≤ 3,524p' → 23,26 ≤ p' ≤ 27,33
Mà trong MXa có 77 hạt proton p' + 17.a = 77 → p' = 77-17a → 82/3,5 ≤ 77 - 17.a ≤ 82/3 → 2,92 ≤ a ≤ 3,16
Vì a nguyên a = 3. Vậy p' = 26. Do đó M là Fe.
Công thức hợp chất là FeCl3.
Câu 2. (2,0 điểm).
1. 2NaOH + Fe(NO3)2 → 2NaNO3 + Fe(OH)2
2NH3 + 2H2O + Fe(NO3)2 → 2NH4NO3 + Fe(OH)2
3Cl2 + 6Fe(NO3)2 → 2FeCl3 + 4Fe(NO3)3
Mg + Fe(NO3)2 → Mg(NO3)2 + Fe
4HNO3 + 3Fe(NO3)2 → 3Fe(NO3)3 + NO + 2H2O
Mời các bạn tải file đầy đủ về tham khảo!




