Giải SBT Khoa học tự nhiên 7 Cánh diều bài 3
Với nội dung bài Giải sách bài tập Khoa học tự nhiên 7 bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7.
Bài: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
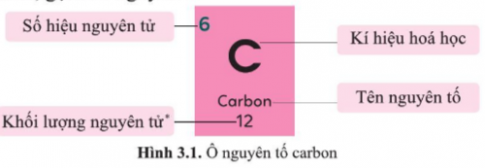
Bài 3.1 trang 9 SBT Khoa học tự nhiên 7: Thông tin trên ô nguyên tố trong bảng tuần hoàn cho biết:
A. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số lớp electron của nguyên tố đó.
B. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số electron lớp ngoài cùng của nguyên tố đó.
C. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó.
D. số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và số điện tích hạt nhân của nguyên tố đó.
Lời giải:
Đáp án đúng là: C
Thông tin trên ô nguyên tố trong bảng tuần hoàn cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó.
Bài 3.2 trang 9 SBT Khoa học tự nhiên 7: Ghép mỗi nội dung ở cột A với nội dung ở cột B để được phát biểu đúng.

Lời giải:
1 – c, e, h.
2 – a.
3 – d.
4 – g.
5 – b.
Bài 3.3 trang 10 SBT Khoa học tự nhiên 7: Điền các thông tin còn thiếu vào các ô trống trong bảng dưới đây:
|
Số thứ tự ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
Số electron |
Chu kì |
Nhóm |
|
8 |
||||||
|
18 |
||||||
|
13 |
||||||
|
19 |
||||||
|
2 |
VIIA |
|||||
|
3 |
IIA |
|||||
|
Phosphorus |
P |
|||||
|
Silicon |
Si |
Lời giải:
|
Số thứ tự ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
Số electron |
Chu kì |
Nhóm |
|
8 |
Oxygen |
O |
8 |
8 |
2 |
VIA |
|
18 |
Argon |
Ar |
18 |
18 |
3 |
VIIIA |
|
13 |
Aluminium |
Al |
13 |
13 |
3 |
IIIA |
|
19 |
Potassium |
K |
19 |
19 |
4 |
IA |
|
9 |
Fluorine |
F |
9 |
9 |
2 |
VIIA |
|
12 |
Magnesium |
Mg |
12 |
12 |
3 |
IIA |
|
15 |
Phosphorus |
P |
15 |
15 |
3 |
VA |
|
14 |
Silicon |
Si |
14 |
14 |
3 |
IVA |
Bài 3.4 trang 10 SBT Khoa học tự nhiên 7: Những phát biểu nào trong các phát biểu dưới đây là đúng?
a) Khối lượng của một nguyên tử bằng tổng số proton của nguyên tử đó.
b) Tất cả nguyên tử của các nguyên tố nhóm VA đều có 5 electron ở lớp ngoài cùng.
c) Tất cả nguyên tử của các nguyên tố ở chu kì II đều có 2 electron ở lớp ngoài cùng.
d) Trong nguyên tử, các electron được xếp theo từng lớp. Các electron được sắp xếp lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài. Mỗi lớp electron có một số electron nhất định.
e) Số thứ tự của nhóm bằng số lớp electron trong nguyên tử của các nguyên tố thuộc nhóm đó.
g) Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố thuộc chu kì đó.
Lời giải:
Các phát biểu b, d, g đúng.
- Phát biểu a sai vì khối lượng nguyên tử được coi bằng tổng khối lượng của proton và neutron có trong nguyên tử.
- Phát biểu c sai vì số thứ tự của chu kì được đánh số từ 1 đến 7, không dùng số La mã.
- Phát biểu e sai vì số thứ tự của nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của nguyên tố thuộc nhóm đó.
Bài 3.5 trang 10 SBT Khoa học tự nhiên 7: Cho biết các nguyên tử của nguyên tố M có 3 lớp electron và có 1 electron ở lớp ngoài cùng. Nguyên tố M có vị trí trong bảng tuần hoàn như sau:
A. ô số 9, chu kì 3, nhóm IA.
B. ô số 10, chu kì 2, nhóm IA.
C. ô số 12, chu kì 3, nhóm IA.
D. ô số 11, chu kì 3, nhóm IA.
Lời giải:
Đáp án đúng là: D
M có 3 lớp electron nên thuộc chu kì 3 ⇒ Loại đáp án B.
M có 1 electron ở lớp ngoài cùng nên thuộc nhóm IA.
M có 3 lớp electron trong đó: lớp thứ nhất có 2 electron, lớp thứ hai có 8 electron, lớp thứ 3 có 1 electron ⇒ M có 11 electron. Vậy M thuộc ô 11 trong bảng tuần hoàn.
Bài 3.6 trang 11 SBT Khoa học tự nhiên 7: Cho biết một nguyên tử của nguyên tố X có điện tích hạt nhân là +17. Hãy chọn câu đúng trong các câu sau:
A. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
B. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 17 electron.
C. Nguyên tố X ở chu kì 2, nhóm VIIA; là kim loại; có 17 proton, 17 electron.
D. Nguyên tố X ở chu kì 2, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
Lời giải:
Đáp án đúng là: B
- X có điện tích hạt nhân là +17 nên nguyên tử X có 17 proton và 17 electron (loại đáp án A và D).
- X có 17 electron được phân vào 3 lớp, vậy X thuộc chu kì 3 (loại đáp án C).
Bài 3.7 trang 11 SBT Khoa học tự nhiên 7: Quan sát mô hình cấu tạo của bốn nguyên tử thuộc bốn nguyên tố có kí hiệu lần lượt là A1, A2, A3, A4 dưới đây:
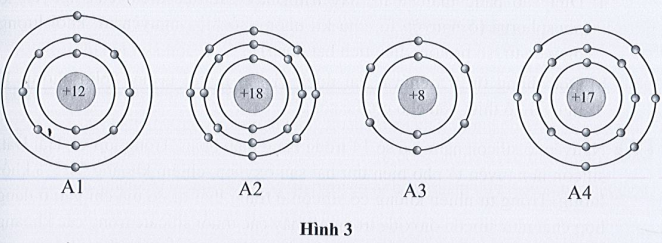
Điền các thông tin còn thiếu vào bảng sau đây:
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
||||
|
Số electron lớp ngoài cùng |
||||
|
Số hiệu nguyên tử |
||||
|
Số proton |
Lời giải:
Chú ý: Trong nguyên tử:
Số hiệu nguyên tử = số proton = số electron.
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
3 |
3 |
2 |
3 |
|
Số electron lớp ngoài cùng |
2 |
8 |
6 |
7 |
|
Số hiệu nguyên tử |
12 |
18 |
8 |
17 |
|
Số proton |
12 |
18 |
8 |
17 |
Bài 3.8 trang 11 SBT Khoa học tự nhiên 7: Quan sát bảng tuần hoàn các nguyên tố hóa học và cho biết:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19.
b) Vì sao các nguyên tố Li, Na và K được xếp vào cùng một cột/ nhóm? Giải thích tương tự với các nguyên tố O, S và Se.
c) Vì sao các nguyên tố B, C, N, O và F được xếp vào cùng một hàng/ chu kì? Giải thích tương tự với các nguyên tố Na, Mg và Al.
d) Vì sao các nguyên tố He, Ne và Ar được xếp vào cùng một cột/ nhóm?
Lời giải:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19 được thể hiện trong bảng sau:
|
Ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
KLNT |
Số electron |
Chu kì |
Nhóm |
Loại nguyên tố |
|
6 |
Carbon |
C |
6 |
12 |
6 |
2 |
IVA |
Phi kim |
|
9 |
Fluorine |
F |
9 |
19 |
9 |
2 |
VIIA |
Phi kim |
|
19 |
Potassium |
K |
19 |
39 |
19 |
4 |
IA |
Kim loại |
b)
- Các nguyên tố Li, Na và K được xếp vào cùng một cột (cùng nhóm IA) vì cả 3 nguyên tố này đều có 1 electron ở lớp ngoài cùng.
- Tương tự, các nguyên tố O, S và Se được xếp vào cùng một cột (nhóm VIA) vì cả 3 nguyên tố đều có 6 electron ở lớp ngoài cùng.
c)
- Các nguyên tố B, C, O và F được xếp vào cùng 1 hàng (chu kì 2) vì cả 5 nguyên tố này đều có 2 lớp electron trong nguyên tử.
- Tương tự, các nguyên tố Na, Mg và Al được xếp vào cùng 1 hàng (chu kì 3) vì nguyên tử của các nguyên tố này đều có 3 lớp electron.
d)
Các nguyên tố He, Ne và Ar đều được xếp vào cùng một cột (nhóm VIIIA) vì cả hai nguyên tố Ne và Ar đều có 8 electron ở lớp ngoài cùng, còn nguyên tố He (đặc biệt) chỉ có 2 electron ở lớp ngoài cùng.
Số electron lớp ngoài cùng là 8 (riêng với He là 2) là cấu trúc bền vững và nhóm này còn có tên gọi là các nguyên tố khí hiếm.
Bài 3.9 trang 12 SBT Khoa học tự nhiên 7: Biết một nguyên tử của nguyên tố X có điện tích hạt nhân là +8. Hãy dự đoán vị trí của X trong bảng tuần hoàn. Cho biết tên của nguyên tố đó. X là nguyên tố kim loại, phi kim hay khí hiếm? Em hãy nêu những hiểu biết khác của mình về nguyên tố X.
Lời giải:
- Nguyên tử nguyên tố X có điện tích hạt nhân là +8 nên số hiệu nguyên tử X là 8.
Vậy X thuộc ô nguyên tố có số thứ tự là 8, chu kì 2 (vì có 2 lớp electron), nhóm VIA (vì có 6 electron ở lớp ngoài cùng).
- Nguyên tố X là nguyên tố oxygen, là nguyên tố phi kim.
- Một số hiểu biết của em về nguyên tố oxygen: Nguyên tố oxygen tạo nên chất oxygen; là một chất khí, không màu, không mùi, không vị, ít tan trong nước, chiếm khoảng 1/5 thể tích không khí. Oxygen duy trì sự sống và sự cháy.
Bài 3.10 trang 12 SBT Khoa học tự nhiên 7: Phosphorus là một trong những thành phần hóa học cấu tạo nên tế bào, được tìm thấy trong chất di truyền, màng tế bào,… có vai trò quan trọng trong các hoạt động sống của tế bào như di truyền, hấp thu dinh dưỡng, … Cùng với calcium, phosphorus có vai trò quan trọng trong việc hình thành cấu trúc xương.
a) Dựa vào bảng tuần hoàn, hãy trình bày các đặc điểm của nguyên tố phosphorus (ô nguyên tố, chu kì, nhóm, số hiệu nguyên tử, khối lượng nguyên tử, số proton, điện tích hạt nhân).
b) Đọc thông tin ở trên và giải thích vì sao người ta nói “phosphorus là nguyên tố thiết yếu cho cơ thể sống”.
Lời giải:
a) Dựa vào bảng tuần hoàn xác định được:
- Phosphorus ở ô số 15, chu kì 3, nhóm VA.
- Số hiệu nguyên tử P là 15.
- Khối lượng nguyên tử P là 31 amu.
- Số proton của P là 15, điện tích hạt nhân nguyên tử P là +15.
b) Người ta nói “phosphorus là nguyên tố thiết yếu cho cơ thể sống” vì:
- Phosphorus là một trong những thành phần hóa học cấu tạo nên tế bào, được tìm thấy trong chất di truyền, màng tế bào,…
- Phosphorus có vai trò quan trọng trong các hoạt động sống của tế bào như di truyền, hấp thu dinh dưỡng, …
- Trong cơ thể ở động vật có xương sống, cùng với calcium, phosphorus có vai trò quan trọng trong việc hình thành cấu trúc xương.
Bài 3.11 trang 12 SBT Khoa học tự nhiên 7: Nguyên tố silicon nằm ở ô thứ 14 trong bảng tuần hoàn. Trong lớp vỏ Trái Đất, silicon là nguyên tố phổ biến thứ hai sau oxygen, chiếm khoảng 29,5 khối lượng. Trong tự nhiên không có silicon ở trạng thái tự do mà chỉ gặp ở dạng hợp chất như silicon dioxide trong cát hay các muối silicate trong các khoáng vật như cao lanh, thạch anh, đá sa thạch,… Silicon có nhiều ứng dụng trong thực tiễn. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử để chế tạo các tế bào quang điện, bộ khuếch đại, bộ chỉnh lưu, pin mặt trời, … Silicon dioxide và các muối silicate được sử dụng rộng rãi trong các vật liệu xây dựng như: đất sét, bê tông, cát và xi măng. Nguyên tố này đóng vai trò quan trọng để tạo ra nơ – ron và mô cơ thể, cũng như tham gia vào quá trình tổng hợp vitamin B1 và thamine ở người.
a) Hãy cho biết các thông tin về nguyên tố silicon trong bảng tuần hoàn.
b) Đọc thông tin ở trên, cho biết vai trò và ứng dụng cơ bản của nguyên tố silicon trong thực tiễn.
Lời giải:
a) Nguyên tố silicon ở ô số 14, chu kì 3, nhóm IVA.
Si có số hiệu nguyên tử là 14; khối lượng nguyên tử là 28 amu; số proton là 14; điện tích hạt nhân là +14.
b) Vai trò và ứng dụng cơ bản của nguyên tố silicon trong thực tiễn:
Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử để chế tạo các tế bào quang điện, bộ khuếch đại, bộ chỉnh lưu, pin mặt trời, … Silicon dioxide và các muối silicate được sử dụng rộng rãi trong các vật liệu xây dựng như: đất sét, bê tông, cát và xi măng. Nguyên tố này đóng vai trò quan trọng để tạo ra nơ – ron và mô cơ thể, cũng như tham gia vào quá trình tổng hợp vitamin B1 và thamine ở người.
Bài 3.12 trang 12 SBT Khoa học tự nhiên 7: Em hãy lựa chọn hai nguyên tố bất kì trong bảng tuần hoàn, tìm hiểu và cho biết các thông tin cơ bản sau:
a) Tên nguyên tố, kí hiệu hóa học, số hiệu nguyên tử, khối lượng nguyên tử; nguyên tố kim loại, phi kim hay khí hiếm.
b) Hãy nêu ứng dụng của từng nguyên tố đó (ít nhất hai ứng dụng).
c) Lịch sử phát hiện ra hai nguyên tố đó.
Lời giải:
Lựa chọn 2 nguyên tố hydrogen và oxygen.
a)
- Hydrogen, kí hiệu hóa học là H, số hiệu nguyên tử là 1, khối lượng nguyên tử 1 amu, là nguyên tố phi kim.
- Oxygen, kí hiệu hóa học là O, số hiệu nguyên tử là 8, khối lượng nguyên tử là 16 amu, là nguyên tố phi kim.
b)
- Ứng dụng của hydrogen:
+ Làm nhiên liệu cho động cơ tên lửa, nhiên liệu động cơ ô tô thay thế cho xăng.
+ Dùng làm chất khử để điều chế kim loại từ những oxide của chúng.
+ Dùng để bơm vào khinh khí cầu, bóng thám không.
+ Là nguyên liệu để sản xuất NH3 (amonia) ; HCl (hydrochloric acid) và nhiều hợp chất hữu cơ.
- Ứng dụng của oxygen:
Oxygen có 2 lĩnh vực ứng dụng quan trọng đó là dùng cho sự hô hấp và sự đốt nhiên liệu:
+ Sự hô hấp: Oxygen cần thiết cho sự hô hấp của người và động vật. Không có khí oxygen người và động vật không sống được…
+ Sự đốt nhiên liệu: Oxygen duy trì sự cháy. Các nhiên liệu cháy trong oxygen nguyên chất tạo nhiệt độ cao hơn trong không khí…
c)
- Lịch sử phát hiện ra hydrogen: Lịch sử hóa học ghi nhận rằng hydrogen được tìm ra vào năm 1766 và nhà Vật lí kiêm Hóa học người Anh là H. Cavendish được công nhận là người tìm ra nguyên tố này.
- Lịch sử phát hiện ra oxygen: Oxygen được phát hiện bởi dược sĩ người Thụy Điển Carl Wilhelm Scheele năm 1771 nhưng phát hiện này không được công nhận ngay. Phát hiện độc lập khác của Joseph Priestley vào ngày 1 tháng 8 năm 1774 được biết đến nhiều hơn vì ấn phẩm của Joseph Priestley được xuất bản trước. Oxygen được Antoine Laurent Lavoisier đặt tên năm 1774.
>>>> Bài tiếp theo: Giải SBT Khoa học tự nhiên 7 Cánh diều bài 4
Trên đây là toàn bộ lời giải Giải SBT KHTN lớp 7 bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Cánh diều. Các em học sinh tham khảo thêm KHTN lớp 7 Kết nối tri thức và KHTN lớp 7 Chân trời sáng tạo. VnDoc liên tục cập nhật lời giải cũng như đáp án sách mới của SGK cũng như SBT các môn cho các bạn cùng tham khảo.







