Lý thuyết Khoa học tự nhiên 7 bài 3 CD
VnDoc xin giới thiệu bài Lý thuyết KHTN lớp 7 bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Cánh diều. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
A. Lý thuyết KHTN 7 bài 3
1.1. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
- Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố hoá học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hoá học tương tự nhau.

1.2. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
a. Ô nguyên tố
- Mỗi nguyên tố hoá học được xếp vào một ô của bảng tuần hoàn, gọi là ô nguyên tố.

Hình 3.1. Ô nguyên tố carbon
- Ô nguyên tố cho biết: số hiệu nguyên tử, kí hiệu hoá học, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó.
Số hiệu nguyên tử (kí hiệu là Z) = số đơn vị điện tích hạt nhân = số proton = số electron trong nguyên tử của nguyên tố
b. Chu kì
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
Số thứ tự của chu kì = số lớp electron trong nguyên tử của các nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ 1 đến 7.
- Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1)
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7)
+ Kết thúc chu kì là một khí hiếm.
Ví dụ: Trong chu kì 3, mở đầu chu kì là nguyên tố sodium (Na), là một kim loại điển hình, cuối chu kì là nguyên tố chlorine (Cl), là một phi kim điển hình và kết thúc chu kì là nguyên tố khí hiếm argon (Ar).
- Chu kì 1 gồm 2 nguyên tố là H và He. Nguyên tử của các nguyên tố này có 1 lớp electron. Điện tích hạt nhân tăng từ H là +1 đến He là +2.
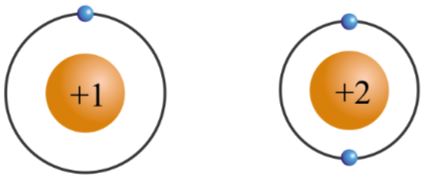
Hình 3.2. Mô hình cấu tạo nguyên tử hydrogen và helium
- Chu kì 2 gồm 8 nguyên tố từ Li đến Ne. Nguyên tử của các nguyên tố này có 2 lớp electron. Điện tích hạt nhân tăng dần từ Li là +3 đến Ne là +10.
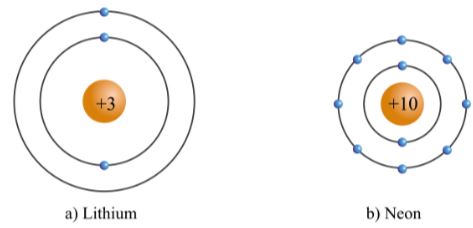
Hình 3.3. Mô hình cấu tạo nguyên tử lithium và neon
- Chu kì 3 gồm 8 nguyên tố từ Na đến Ar. Nguyên tử của các nguyên tố này có 3 lớp electron. Điện tích hạt nhân tăng dần từ Na là +11 đến Ar là +18.
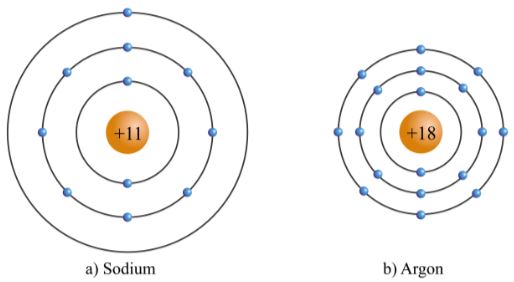
Hình 3.4. Mô hình cấu tạo nguyên tử sodium và argon
c. Nhóm
- Nhóm gồm các nguyên tố có tính chất hoá học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B (còn gọi là nhóm các nguyên tố kim loại chuyển tiếp).
- Nhóm A được đánh số thứ tự bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
Số thứ tự của nhóm A = số electron lớp ngoài cùng trong nguyên tử của nguyên tố thuộc nhóm đó
+ Nhóm IA gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H). Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân của các nguyên tử kim loại trong nhóm IA tăng dần từ Li (+3) đến Fr (487).
+ Nhóm VIIA gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts). Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân của các nguyên tử phi kim trong nhóm VIIA tăng dần từ F (49) đến At (+85).
+ Nhóm VIIIA gồm các nguyên tố khí hiếm. Nguyên tử của chúng đều có 8 electron ở lớp ngoài cùng (trừ helium). Điện tích hạt nhân tăng dần từ He (+2) đến Og (+118).

Hình 3.6. Nhóm IA và VIIA trong bảng tuần hoàn
1.3. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
Các nguyên tố hoá học được chia thành ba loại: kim loại, phi kim và khí hiếm.
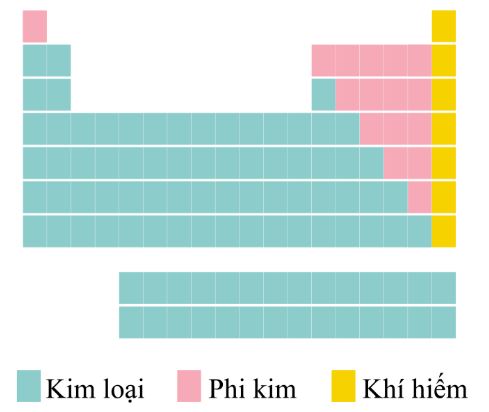
Hình 3.7. Vị trí của các nguyên tố kim loại, phi kim, khí hiếm trong bảng tuần hoàn
Các nguyên tố kim loại
- Hơn 80% các nguyên tố trong bảng tuần hoàn là kim loại.
- Vị trí: ở phía bên trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố nhóm IA (trừ hydrogen) đều là kim loại điển hình.
Các nguyên tố phi kim
- Vị trí: ở phía trên, bên phải của bảng tuần hoàn (các phi kim hoạt động mạnh nằm ở phía trên).
- Các nguyên tố nhóm VIIA hầu hết là những phi kim điển hình, fluorine ở đầu nhóm là phi kim hoạt động mạnh nhất.
Các nguyên tố khí hiếm
- Vị trí: Tất cả các nguyên tố nằm trong nhóm VIIIA
1.4. Ý nghĩa của bảng tuần hoàn
- Sử dụng bảng tuần hoàn để biết các thông tin của một nguyên tố hoá học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hoá học, khối lượng nguyên tử.
- Sử dụng bảng tuần hoàn để biết vị trí của nguyên tố hoá học (ô, chu kì, nhóm). Từ đó nhận ra được nguyên tố kim loại, phi kim hay khí hiếm.
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố ở nhóm VIIIA là khí hiếm.
Ví dụ: Sử dụng bảng tuần hoàn biết được nguyên tố sulfur (S) ở ô số 16, chu kì 3, nhóm VIA và đó là nguyên tố phi kim.
|
1. Nguyên tắc sắp xếp các nguyên tố hoá học trong bảng tuần hoàn: Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. Các nguyên tố cùng chu kì có cùng số lớp electron. Các nguyên tố cùng nhóm có tính chất hoá học tương tự nhau. 2. Bảng tuần hoàn gồm các nguyên tố hoá học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm. Số hiệu nguyên tử (kí hiệu là Z) = số đơn vị điện tích hạt nhân = số proton = số electron trong nguyên tử của nguyên tố Số thứ tự của chu kì = số lớp electron trong nguyên tử của các nguyên tố Số thứ tự của nhóm A = số electron lớp ngoài cùng trong nguyên tử của nguyên tố 3. Bảng tuần hoàn cho biết: các thông tin của một nguyên tố; vị trí của các nguyên tố; nguyên tố đó là kim loại, phi kim hay khí hiếm.
|
B. Bài tập minh họa
Bài 1: Quan sát mô hình cấu tạo của bốn nguyên tử thuộc bốn nguyên tố có kí hiệu lần lượt là A1, A2, A3, A4 dưới đây:
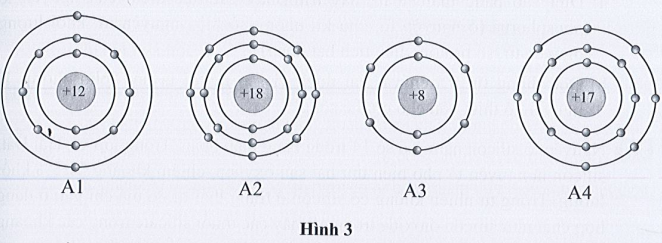
Điền các thông tin còn thiếu vào bảng sau đây:
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
|
|
|
|
|
Số electron lớp ngoài cùng |
|
|
|
|
|
Số hiệu nguyên tử |
|
|
|
|
|
Số proton |
|
|
|
|
Hướng dẫn giải
Trong nguyên tử: số hiệu nguyên tử = số proton = số electron
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
3 |
3 |
2 |
3 |
|
Số electron lớp ngoài cùng |
2 |
8 |
6 |
7 |
|
Số hiệu nguyên tử |
12 |
18 |
8 |
17 |
|
Số proton |
12 |
18 |
8 |
17 |
Bài 2: Quan sát bảng tuần hoàn, ô nguyên tố số 11 và cho biết:
a) Tên nguyên tố, kí hiệu nguyên tố hóa học, khối lượng nguyên tử, số hiệu nguyên tử
b) Số proton, số electron và số lớp electron
c) Những nguyên tố nào trong bảng tuần hoàn có tính chất hóa học tương tự nguyên tố trên
Hướng dẫn giải
a) Ô nguyên tố số 11 là nguyên tố sodium (Na), khối lượng nguyên tử bằng 23, số hiệu nguyên tử bằng 11
b) Số hiệu nguyên tử = số proton = số electron = 11
Số lớp electron = số thứ tự chu kì = 3
Nguyên tố sodium (Na) có 11 proton trong hạt nhân, 11 electron và có 3 lớp electron trong nguyên tử
c) Những nguyên tố kim loại thuộc nhóm IA có tính chất tương tự nguyên tố Na (vì nguyên tố Na là nguyên tố kim loại thuộc nhóm IA): Li, K, Rb, Cs, Fr
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học CD trên đây các bạn có thể tham khảo Địa lý 7 Cánh diều và Lịch sử 7 Cánh diều, Công Nghệ 7 CD,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.







