Lý thuyết Khoa học tự nhiên 7 bài 5 CD
Lý thuyết KHTN lớp 7 bài 5: Giới thiệu về liên kết hóa học được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Cánh diều. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Giới thiệu về liên kết hóa học
A. Lý thuyết KHTN 7 bài 5
1.1. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
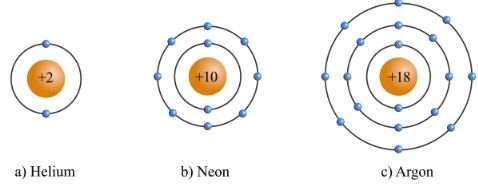
Hình 5.1. Mô hình cấu tạo nguyên tử của một số nguyên tố khí hiếm
- Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững.
=> Các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
=> Nguyên tử của các nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
1.2. Liên kết ion
a. Sự tạo thành liên kết trong phân tử sodium chloride
- Khi Na kết hợp với Cl tạo thành phân tử sodium chloride sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang một điện tích dương, kí hiệu là Na+ (hình 5.2).
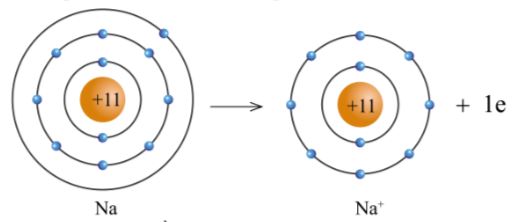
Hình 5.2. Sơ đồ nguyên tử Na cho electron tạo ra ion Na +
+ Nguyên tử Cl nhận 1 electron từ nguyên tử Na trở thành ion mang một điện tích âm, kí hiệu là Cl- (hình 5.3).
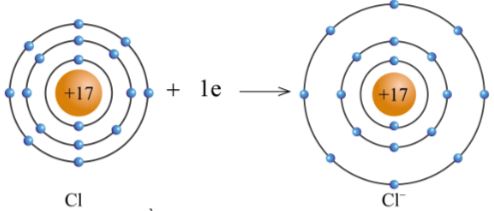
Hình 5.3. Sơ đồ nguyên tử Cl nhận electron tạo ra ion Cl -
- Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử sodium chloride (hình 5.4).
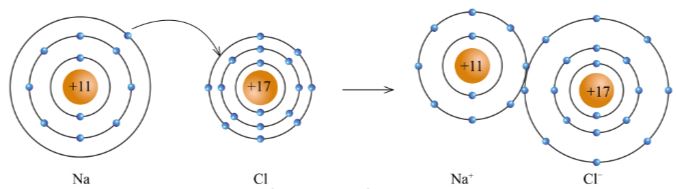
Hình 5.4. Sơ đồ tạo thành liên kết trong phân tử sodium chloride
b. Sự tạo thành liên kết trong phân tử magnesium oxide
- Khi Mg kết hợp với O tạo thành phân tử magnesium oxide sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Mg2+ (hình 5.5).
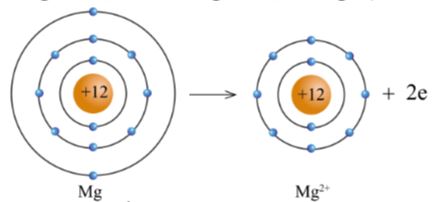
Hình 5.5. Sơ đồ nguyên tử Mg cho electron tạo ra ion Mg2+
+ Nguyên tử O nhận 2 electron từ nguyên tử Mg tạo thành ion mang hai điện tích âm, kí hiệu là O2- (hình 5.6).
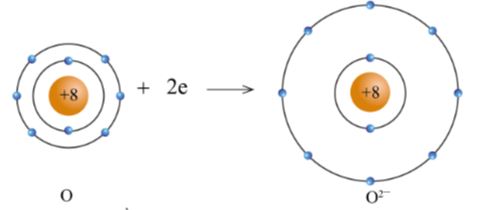
Hình 5.6. Sơ đồ nguyên tử O nhận electron tạo ra ion O2-
- Các ion Mg 2+ và O 2- hút nhau tạo thành liên kết trong phân tử magnesium oxide (hình 5.7).
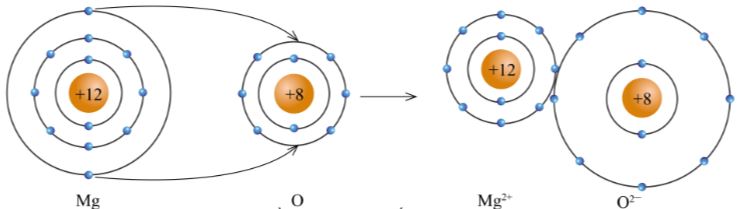
Hình 5.7. Sơ đồ tạo thành liên kết trong phân tử magnesium oxide
Khi kim loại điển hình kết hợp với phi kim điển hình, nguyên tử kim loại sẽ cho electron tạo thành ion dương, nguyên tử phi kim sẽ nhận electron tạo thành ion âm. Các ion dương và ion âm hút nhau, tạo ra hợp chất ion.
Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm.
Chất được tạo thành bởi các ion dương và ion âm được gọi là hợp chất ion, có những tính chất chung sau:
- Là chất rắn ở điều kiện thường.
Ví dụ: sodium chloride, calcium oxide...
- Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Ví dụ: aluminium oxide, calcium oxide, sodium chloride,...
- Khi tan trong nước tạo ra dung dịch dẫn được điện.
Ví dụ: sodium chloride, calcium chloride,...

Hình 5.8. Một số hợp chất ion
1.3. Liên kết cộng hóa trị
a. Sự tạo thành liên kết trong phân tử hydrogen
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung (hình 5.9).
- Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử hydrogen.
=> Tạo liên kết như vậy được gọi là liên kết cộng hoá trị.
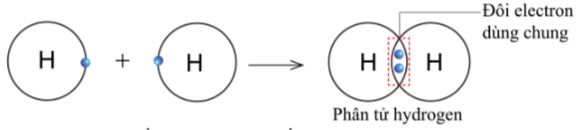
Hình 5.9. Sơ đồ tạo thành liên kết trong phân tử hydrogen
b. Sự tạo thành liên kết trong phân tử nước
- Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron
=> Giữa nguyên tử O và H có một đôi electron dùng chung (hình 5.10).
-- Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
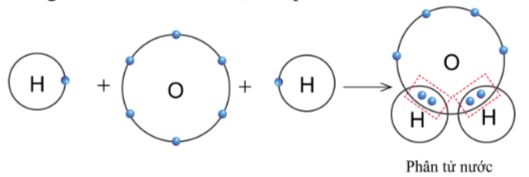
Hình 5.10. Sơ đồ tạo thành liên kết trong phân tử nước
c. Sự tạo thành liên kết trong phân tử carbon dioxide
- Nguyên tử C có 4 electron ở lớp ngoài cùng và cần thêm 4 electron để đạt được lớp vỏ bền vững tương tự khí hiếm Ne.
- Trong phân tử carbon dioxide, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron.
=> Giữa nguyên tử C và O có hai đôi electron dùng chung (hình 5.11).
- Hạt nhân nguyên tử C và o cùng hút đôi electron dùng chung, liên kết với nhau tạo thành phân tử carbon dioxide.
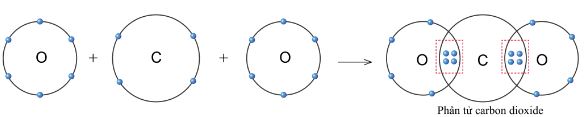
Hình 5.11. Sơ đồ tạo thành liên kết trong phân tử carbon dioxide
Liên kết cộng hoá trị là liên kết được tạo thành bởi một hoặc nhiều đối electron dùng chung giữa hai nguyên tử.
Chất được tạo thành nhờ liên kết cộng hoá trị giữa các nguyên tử được gọi là chất cộng hoá trị.
Trong điều kiện thường, các chất cộng hoá trị có ở cả ba thể:
- Thể rắn (đường ăn, iodine,...)
- Thể lỏng (bromine, ethanol,...)
- Thế khí (oxygen, nitrogen, carbon dioxide,...).
Các chất cộng hoá trị thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp. Nhiều chất cộng hoá trị không dẫn điện (đường ăn, ethanol,...).
|
1. Lớp vỏ ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng helium có 2 electron), là lớp vỏ bền vững. 2. Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm. 3. Liên kết cộng hoá trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử. 4. Các chất ion là chất rắn ở điều kiện thường, có nhiệt độ sôi và nhiệt độ nóng chảy cao, khi tan trong nước tạo ra dung dịch dẫn điện. 5. Các chất cộng hóa trị có ở cả ba thể (rắn, lỏng, khí), thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp. Nhiều chất cộng hoá trị không dẫn điện. |
B. Bài tập minh họa
Bài 1: Hạt nhân của nguyên tử X có 3 proton, tổng số electron có trong nguyên tử Y là 9.
a) Nguyên tử X có tạo ra được liên kết với nguyên tử Y không?
b) Nếu X và Y liên kết được với nhau thì liên kết đó là liên kết ion hay liên kết cộng hóa trị?
Hướng dẫn giải
a) Nguyên tử X có 3 proton, do đó số electron của X là 3 và lớp ngoài cùng có 1 electron nên X là kim loại.
Nguyên tử Y có 9 electron, do đó lớp ngoài cùng của Y có 7 electron nên Y là phi kim.
Vậy nguyên tử X có tạo ra được liên kết với nguyên tử Y, do các nguyên tử này đều chưa đạt được lớp ngoài cùng bền vững giống với khí hiếm.
b) X là kim loại điển hình, Y là phi kim điển hình nên X liên kết với Y bằng liên kết ion.
Bài 2: Magnesium oxide (gồm 1 nguyên tử magnesium và 1 nguyên tử oxygen) có nhiều ứng dụng trong đời sống. Nó là thành phần chính trong các lò sản xuất sắt, thép, các kim loại màu, thủy tinh hay xi măng,… Vẽ sơ đồ hình thành phân tử magnesium oxide và tính khối lượng phân tử của nó.

Hướng dẫn giải:
- Nguyên tử của nguyên tố magnesium nhường 2 electron lớp ngoài cùng để tạo thành ion dương có 8 electron lớp ngoài cùng bền vững.
- Nguyên tử của nguyên tố oxygen nhận 2 electron để tạo ion âm có 8 electron lớp ngoài cùng bền vững.
- Hai ion trái dấu hút nhau bằng lực hút tĩnh điện và tạo thành liên kết ion
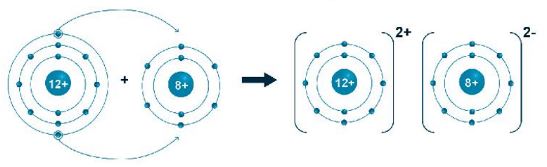
- Phân tử magnesium oxide được tạo bởi một nguyên tử của nguyên tố Mg và một nguyên tử của nguyên tố O
=> Khối lượng phân tử magnesium oxide là: 24.1+ 16.1 = 40 (amu)
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 5: Giới thiệu về liên kết hóa học CD trên đây các bạn có thể tham khảo Địa lý 7 Cánh diều và Lịch sử 7 Cánh diều, Công Nghệ 7 CD,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.








