Lý thuyết Khoa học tự nhiên 7 bài 6 CD
VnDocxin giới thiệu bài Lý thuyết KHTN lớp 7 bài 6: Hóa trị, công thức hóa học được sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Cánh diều. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Hóa trị, công thức hóa học
A. Lý thuyết KHTN 7 bài 6
1.1. Hóa trị
a. Khái niệm hóa trị
- Xét phân tử hydrogen chloride:
Khi tạo thành phân tử hydrogen chloride, mỗi nguyên tử H và Cl góp 1 electron tạo ra đôi electron dùng chung giữa hai nguyên tử (hình 6.1) Người ta nói, H và Cl có hoá trị I
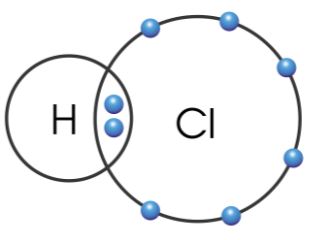
Hình 6.1. Sơ đồ liên kết cộng hoá trị giữa H và Cl trong phân tử hydrogen chloride
- Xét phân tử nước: Khi H kết hợp với O, mỗi nguyên tử H góp chung 1 electron, nguyên tử O góp chung 2 electron (hình 6.2). Nguyên tử O liên kết với hai nguyên tử H bằng hai đôi electron chung. Người ta nói, H có hoá trị I và O có hóa trị II.
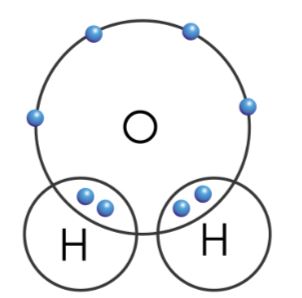
Hình 6.2. Sơ đồ liên kết cộng hoá trị giữa H và O trong phân tử nước
- Hoá trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
- Trong hợp chất, H luôn có hoá trị I, O luôn có hóa trị II.
Bảng 6.1. Hóa trị của một số nguyên tố
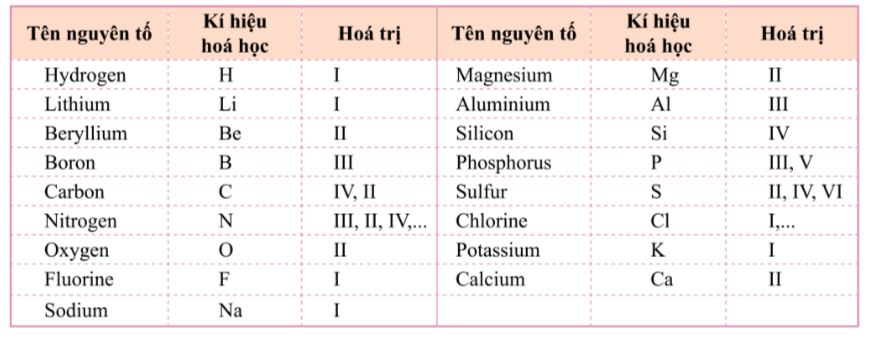
Bảng 6.2. Hóa trị của một số nhóm nguyên tử

b. Quy tắc hóa trị
- Khi hai nguyên tố kết hợp với nhau, hoá trị của nguyên tố có liên quan đến số lượng nguyên tử của mỗi nguyên tố tham gia liên kết.
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Ví dụ: Trong phân tử nước, hóa trị và số nguyên tử tham gia liên kết của H và O như sau:
|
Nguyên tố |
H |
O |
|
Hóa trị |
I |
II |
|
Số nguyên tử |
2 |
1 |
|
Tích hóa trị và số nguyên tử |
I.2 = II.1 |
|
Ta có tích của hóa trị và số nguyên tử tham gia liên kết của H và O bằng nhau.
1.2. Công thức hóa học
a. Công thức hóa học
- Công thức hóa học để biểu diễn chất.
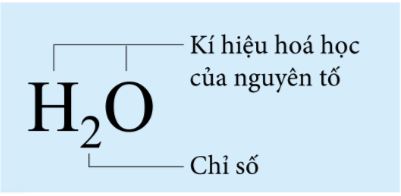
Ví dụ: Công thức hóa học của nước là H2O.
- Công thức hóa học có hai phần: phần chữ và phần số.
+ Phần chữ: gồm kí hiệu hóa học của các nguyên tố tạo thành chất.
+ Phần số: gồm các số được ghi bên phải, dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong một phân tử (nếu chỉ có một nguyên tử thì không ghi).
- Công thức hóa học của các hợp chất: NaCl, Na2O, H2SO4, CaCO3,...
- Công thức hóa học của các đơn chất:
+ Với phi kim, phân tử thường có hai nguyên tử.
Ví dụ: N2, H2, O2, Cl2,...
+ Với kim loại và một số phi kim, kí hiệu hoá học của nguyên tố được coi là công thức hóa học của đơn chất.
Ví dụ: Các kim loại như: Fe, Cu, Al, Na, Ca,... và một số phi kim như: C, S, P,...
b. Ý nghĩa của công thức hóa học
Công thức hóa học của một chất cho biết một số thông tin
- Nguyên tố tạo ra chất.
- Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
- Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của sulfuric acid là H2SO4 cho biết:
+ Sulfuric acid được tạo thành từ H, S và O.
+ Trong một phân tử sulfuric acid có 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O.
+ Khối lượng phân tử của sulfuric acid là: 2.1 +1.32 + 4.16 = 98 (amu).
Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
Khi biết công thức hóa học của một chất, tính được thành phần phần trăm khối lượng của các nguyên tố tạo ra chất theo các bước sau:
- Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất.
- Tính khối lượng phân tử.
- Tính phần trăm khối lượng của nguyên tố theo công thức:
(Khối lượng nguyên tố : Khối lượng phân tử hợp chất) × 100%
Ví dụ: Tính phần trăm khối lượng của Mg, O trong hợp chất MgO.
Ta có: Khối lượng của nguyên tố O trong MgO là:
1.16 = 16 (amu)
Khối lượng của nguyên tố Mg trong MgO là:
1.24 = 24 (amu)
=> Khối lượng của phân tử MgO là 16 + 24 = 40 (amu)
Phần trăm khối lượng của mg trong hợp chất MgO là:
![]() \(\frac{{24}}{{40}}.100\% = 60\%\)
\(\frac{{24}}{{40}}.100\% = 60\%\)
Phần trăm khối lượng của O trong hợp chất MgO là:
![]() \(\frac{{16}}{{40}}.100\% = 40\%\)
\(\frac{{16}}{{40}}.100\% = 40\%\)
Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
Cách xác định hóa trị khi biết công thức hóa học và hóa trị của một nguyên tố:
- Đặt hóa trị của nguyên tố chưa biết là a.
- Xác định a dựa vào quy tắc hóa trị.
Ví dụ: Xác định hóa trị của Fe trong hợp chất có công thức hóa học Fe2O3.
+ Gọi hóa trị của Fe trong hợp chất là a.
+ Vì O có hóa trị II nên khi áp dụng quy tắc hóa trị, ta có: a.2 = II.3
=> a = III
+ Vậy Fe có hóa trị III trong hợp chất Fe 2 O 3 .
c. Xác định công thức hóa học của hợp chất
Xác định công thức hóa học của hợp chất khi biết hóa trị của các nguyên tố
Nếu hai nguyên tố A, B có hóa trị tương ứng là a, b thì công thức hóa học của hợp chất tạo thành từ A và B được xác định như sau:
- Đặt công thức hóa học của hợp chất AxBy.
- Áp dụng quy tắc hóa trị, xác định tỉ lệ ![]() \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{\rm{b}}}{{\rm{a}}}\)
\(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{\rm{b}}}{{\rm{a}}}\)
- Xác định x, y (x, y thường là những số nguyên tố nhỏ nhất thỏa mãn tỉ lệ trên).
Ví dụ: Lập công thức hóa học của hợp chất được tạo bởi S hóa trị IV và O.
+ Đặt công thức của hợp chất là SxOy.
+ Theo quy tắc hóa trị: x.IV = y.II
+ Ta có tỉ lệ:
![]() \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{VI}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{3}}}\)
\(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{VI}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{3}}}\)
Chọn x = 1 và y = 3
+ Công thức hóa học của hợp chất là: SO3.
Xác định công thức hóa học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất
Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó, xác định công thức hóa học theo bước sau:
- Đặt công thức hóa học của hợp chất A x B y
- Tính khối lượng của A, B trong một phân tử chất.
- Tìm x, y.
Ví dụ: R là hợp chất của S và O, khối lượng phân tử của R là 64 amu. Biết phần trăm khối lượng của oxygen trong R là 50%. Hãy xác định công thức hóa học của R.
+ Đặt công thức hóa học của R là S x O y
+ Khối lượng của nguyên tố O trong một phân tử R là:
![]() \(\frac{{{\rm{64}}{\rm{.50}}}}{{{\rm{100}}}}{\rm{ = 32 (amu)}}\)
\(\frac{{{\rm{64}}{\rm{.50}}}}{{{\rm{100}}}}{\rm{ = 32 (amu)}}\)
+ Khối lượng của nguyên tố S trong một phân tử R là:
64 – 32 = 32 (amu)
+ Ta có:
16.y = 32 (amu) ⇒ y = 2
32. x = 32 (amu) ⇒ x = 1
Vậy công thức hóa học của R là SO2.
|
1. Hóa trị của nguyên tố là con số biểu thị khả năng liên kết của nguyên tử trong hợp chất. Trong hợp chất, hóa trị của H luôn là 1, hóa trị của O luôn là II. 2. Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B. 3. Công thức hóa học dùng để biểu diễn chất. Công thức hóa học gồm hai phần: chữ và số. Phần chữ là kí hiệu hóa học của các nguyên tố; phần số được ghi bên phải, dưới chân kí hiệu hoá học (gọi là chỉ số) là số nguyên tử của nguyên tố trong phân tử. |
B. Bài tập minh họa
Bài 1: Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hóa học là C 6 H 12 O 6 .
Hãy cho biết:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong một phân tử glucose là bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Hướng dẫn giải
a) Glucose được tạo thành từ những nguyên tố: C, H và O
b) Nguyên tố C: Có 6 nguyên tử C (khối lượng nguyên tử: 12 amu)
→ Khối lượng nguyên tố C trong 1 phân tử glucose = 12 amu x 6 = 72 amu
- Nguyên tố H: Có 12 nguyên tử H (khối lượng nguyên tử: 1 amu)
→ Khối lượng nguyên tố H trong 1 phân tử glucose = 1 amu x 12 = 12 amu
- Nguyên tố O: Có 6 nguyên tử O (khối lượng nguyên tử: 16 amu)
→ Khối lượng nguyên tố O trong 1 phân tử glucose = 16 amu x 6 = 96 amu
c) Khối lượng phân tử glucose = khối lượng nguyên tố C + khối lượng nguyên tố H + khối lượng nguyên tố O
= 72 amu + 12 amu + 96 amu = 180 amu
Bài 2: Hợp chất (E) là oxide của nguyên tố M có hoá trị VI. Biết (E) có khối lượng phân tử bằng 80 amu. Hãy xác định công thức hoá học của hợp chất (E).
Hướng dẫn giải
- Gọi công thức hóa học chung của E là: M x O y (M có hóa trị VI và O có hóa trị II)
- Theo quy tắc hóa trị ta có: x.VI = y.II
Chuyển về tỉ lệ:
![]() \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{VI}}}}{\rm{ = }}\frac{1}{3}\)
\(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{VI}}}}{\rm{ = }}\frac{1}{3}\)
- Chọn x = 1; y = 3. Vậy công thức hóa học của hợp chất E là MO 3 .
- Khối lượng phân tử của E bằng 80:
KLPT(MO 3 ) = KLNT(M) + 16.3 = 80 amu
⇒ KLNT (M) = 32 amu. Vậy M là S.
Công thức hóa học của hợp chất E là SO 3 .
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 6: Hóa trị, công thức hóa học CD trên đây các bạn có thể tham khảo Địa lý 7 Cánh diều và Lịch sử 7 Cánh diều, Công Nghệ 7 CD,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.








