Lý thuyết Khoa học tự nhiên 7 bài 1 CD
Chúng tôi xin giới thiệu bài Lý thuyết KHTN lớp 7 bài 1: Nguyên tử được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Cánh diều. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Nguyên tử
A. Lý thuyết KHTN 7 bài 1
1.1. Nguyên tử
- Mọi chất đều được cấu tạo từ những hạt cực kì nhỏ bé, không mang điện được gọi là nguyên tử.
Ví dụ:
- Đồng tiền vàng được cấu tạo từ các nguyên tử vàng (gold).
- Khí oxygen được cấu tạo từ các nguyên tử oxygen.
- Kim cương, than chì đều được cấu tạo từ các nguyên tử carbon.
- Nước được tạo nên từ các nguyên tử hydrogen và oxygen.
- Đường ăn được tạo nên từ các nguyên tử carbon, oxygen và hydrogen.
1.2. Cấu tạo nguyên tử
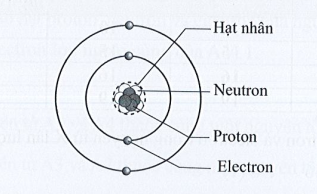
Cấu tạo của nguyên tử gồm vỏ nguyên tử và hạt nhân nguyên tử.
a. Vỏ nguyên tử
- Vỏ nguyên tử được tạo bởi một hay nhiều electron chuyển động xung quanh hạt nhân.
- Electron kí hiệu là e, mang điện tích âm và có giá trị bằng một điện tích nguyên tố, được viết đơn giản là -1.
b. Hạt nhân nguyên tử
- Hạt nhân nằm ở tâm và có kích thước rất nhỏ so với kích thước của nguyên tử.
- Hạt nhân nguyên tử được tạo bởi các proton và neutron.
+ Proton kí hiệu là p, mang điện tích dương và có giá trị bằng một điện tích nguyên tố, được viết là +1. Điện tích của proton bằng điện tích của electron về độ lớn nhưng khác dấu.
+ Neutron kí hiệu là n, không mang điện.
- Điện tích của hạt nhân nguyên tử bằng tổng điện tích của các proton. Số đơn vị điện tích hạt nhân bằng số proton.
Ví dụ: Nguyên tử nitrogen (nitơ) có 7 proton nên nitrogen có điện tích hạt nhân là +7, số đơn vị điện tích hạt nhân là 7.
Trong nguyên tử, số electron bằng số proton.
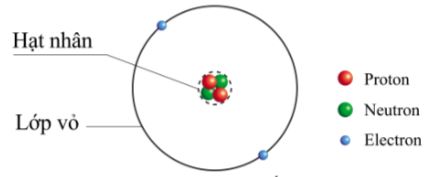
Hình 1.2. Mô hình cấu tạo nguyên tử helium
Nguyên tử helium gồm hạt nhân có 2 proton, 2 neutron và vỏ nguyên tử có 2 electron.
1.3. Sự chuyển động của electron trong nguyên tử
- Theo mô hình của Rơ-do-pho - Bo, trong nguyên tử, các electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân, như các hành tinh quay quanh Mặt Trời.
- Trong nguyên tử, các electron được xếp thành từng lớp.
+ Các electron được sắp xếp lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài.
+ Mỗi lớp có số electron tối đa xác định: lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,...
Ví dụ: Nguyên tử oxygen có 8 electron, được phân bố thành hai lớp electron, lớp thứ nhất có 2 electron, lớp thứ hai có 6 electron. Ta nói nguyên tử oxygen có 6 electron ở lớp ngoài cùng.
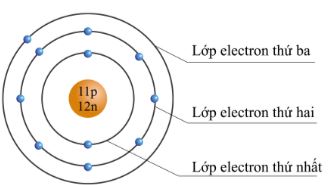
Hình 1.4. Mô hình cấu tạo nguyên tử sodium
1.4. Khối lượng nguyên tử
- Nguyên tử có khối lượng rất nhỏ. Do vậy, để biểu thị khối lượng của nguyên tử, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu (atomic mass unit).
1 amu = 1,6605 x 10-24 g
- Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron và electron trong nguyên tử đó.
- Có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân ( Vì proton và neutron đều có khối lượng xấp xỉ bằng 1 amu; khối lượng của electron là 0,00055 amu, nhỏ hơn nhiều lần so với khối lượng của proton và neutron)
Ví dụ: Nguyên tử hydrogen chỉ có 1 proton, nên khối lượng nguyên tử hydrogen là 1 amu. Nguyên tử oxygen có 8 proton và 8 neutron, nên khối lượng nguyên tử oxygen là: 8.1 + 8.1= 16 (amu).
|
1. Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất. 2. Cấu tạo nguyên tử gồm vỏ nguyên tử và hạt nhân nguyên tử. Hạt nhân của nguyên tử mang điện tích dương, được tạo bởi các proton và neutron. Vỏ nguyên tử gồm một hay nhiều electron mang điện tích âm. số electron bằng số proton. 3. Theo mô hình Rơ-dơ-pho - Bo, trong nguyên tử, electron phân bố trên các lớp electron và chuyển động quanh hạt nhân nguyên tử trên những quỹ đạo xác định. 4. Khối lượng nguyên tử được coi bằng tổng khối lượng của proton và neutron có trong nguyên tử, được tính bằng đơn vị amu. |
B. Bài tập minh họa
Bài 1: Gọi tên các thành phần của một nguyên tử (hạt nhân, proton, neutron, electron) được mô tả như dưới đây.
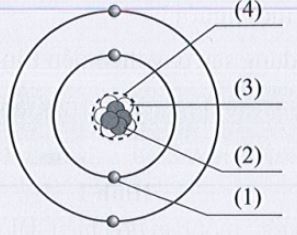
Hướng dẫn giải
Gọi tên các thành phần của một nguyên tử theo hình ảnh sau:
Bài 2: Quan sát mô hình nguyên tử carbon và cho biết:
a) Số proton và số electron
b) Điện tích hạt nhân và số đơn vị điện tích hạt nhân
c) Số lớp electron và số electron trên mỗi lớp?
d) Xác định khối lượng nguyên tử carbon (biết số neutron bằng 6)
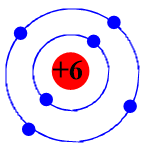
Mô hình nguyên tử carbon (C)
Hướng dẫn giải
a) Số p = số e = 6
b) Điện tích hạt nhân bằng +6. Số đơn vị điện tích hạt nhân bằng 6.
c) Có 2 lớp electron. Lớp 1 có 2 electron, lớp 2 có 4 electron.
d) Khối lượng hạt nhân được xem là khối lượng của nguyên tử.
Khối lượng của nguyên tử carbon: 6 + 6 = 12 (do khối lượng 1 p ≈ 1n ≈ 1 amu)
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 1: Nguyên tử CD trên đây các bạn có thể tham khảo Địa lý 7 Cánh diều và Lịch sử 7 Cánh diều, Công Nghệ 7 CD,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.







