Lý thuyết Khoa học tự nhiên 9 Chân trời sáng tạo bài 17
Lý thuyết Khoa học tự nhiên 9 bài 17: Dãy hoạt động hóa học của kim loại - Một số phương pháp tách kim loại có nội dung chi tiết và các câu trắc nghiệm trong chương trình sách mới. Các bạn có thể tham khảo để chuẩn bị tốt cho bài học mới trong chương trình sách Chân trời sáng tạo
Bài: Dãy hoạt động hóa học của kim loại - Một số phương pháp tách kim loại
1. Xây dựng dãy hoạt động hóa học của kim loại
- Dãy hoạt động hóa học của kim loại được xây dựng dựa trên các thí nghiệm để xác định mức độ hoạt động hóa học của kim loại như sau:
+ Thí nghiệm phản ứng của kim loại với nước
Ví dụ: Cho 2 kim loại Na và Mg phản ứng với nước:
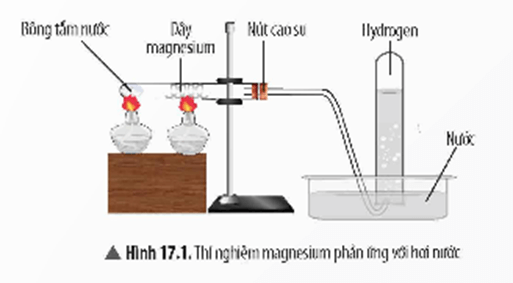
+ Thí nghiệm phản ứng của kim loại với dung dịch hydrochloric acid
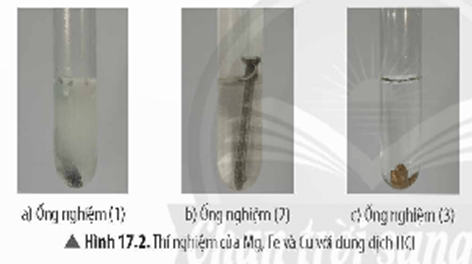
+ Thí nghiệm phản ứng của kim loại với dung dịch muối

- Dãy hoạt động hoá học của một số kim loại:
K, Na, Ca, Mg, Al, Zn, Fe, Pb, (H),Cu, Ag, Au
2. Ý nghĩa của dãy hoạt động hóa học của kim loại
Dựa vào dãy hoạt động hoá học của kim loại, ta biết:
1. Mức độ hoạt động hoá học của các kim loại giảm dần từ trái sang phải.
2. Kim loại đứng trước Mg phản ứng được với nước ở nhiệt độ thường tạo thành dung dịch base và giải phóng khí H2.
3. Kim loại đứng trước H tác dụng được với dung dịch acid (HCl, H2SO4 loãng,…) giải phóng khí H2.
4. Các kim loại đứng trước (trừ Na, K,…) có thể đẩy kim loại đứng sau ra khỏi dung dịch muối.
3. Tách một số kim loại có nhiều ứng dụng
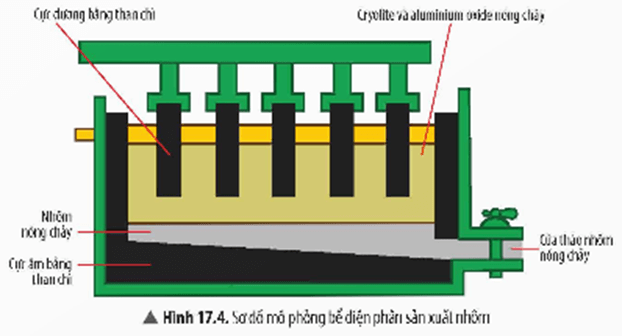
a) Phương pháp điện phân nóng chảy
- Được sử dụng để điều chế các kim loại hoạt động hoá học mạnh như Li, Na, K, Ca,… từ những hợp chất của chúng (muối, oxide,…)
- Ví dụ: Nhôm được sản xuất từ quặng bauxite (thành phần chủ yếu là aluminium oxide)
2Al2O3![]() \(\overset{dpnc,cryolite}{\rightarrow}\)4Al+3O2↑
\(\overset{dpnc,cryolite}{\rightarrow}\)4Al+3O2↑
c) Phương pháp nhiệt luyện
- Sử dụng các chất phản ứng thích hợp (Al, C, CO,…) để tách các kim loại hoạt động hoá học trung bình (Fe, Zn, Pb,…) ra khỏi oxide của chúng.
- Ví dụ 1: Tách sắt ra khỏi hợp chất iron (III) oxide:
Fe2O3+3CO![]() \(\overset{to}{\rightarrow}\)2Fe+3CO2
\(\overset{to}{\rightarrow}\)2Fe+3CO2
- Ví dụ 2: Sản xuất kẽm từ quặng sphalerite (chứa zinc sulfide, ZnS):
+ Nung nóng quặng sphalerite ở nhiệt độ cao với luồng không khí trong lò để chuyển thành zinc oxide.
2ZnS+3O2![]() \(\overset{to}{\rightarrow}\)2ZnO+2SO2↑
\(\overset{to}{\rightarrow}\)2ZnO+2SO2↑
+ ZnO phản ứng với C ở nhiệt độ cao thu được kẽm.
ZnO+C![]() \(\overset{to}{\rightarrow}\)Zn+CO↑
\(\overset{to}{\rightarrow}\)Zn+CO↑
>>>> Bài tiếp theo: Lý thuyết Khoa học tự nhiên 9 Chân trời sáng tạo bài 18









