Lý thuyết Khoa học tự nhiên 9 Kết nối tri thức bài 18
Với nội dung bài Lý thuyết Khoa học tự nhiên lớp 9 bài 18: Tính chất chung của kim loại sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 9.
Bài: Tính chất chung của kim loại
I. Tính chất vật lí của kim loại
Kim loại có các tính chất vật lí chung như sau:
- Tính dẻo.
- Tính dẫn điện, dẫn nhiệt.
- Ánh kim.

Lưu ý:
- Kim loại dẻo nhất (dễ dát mỏng, dễ kéo sợi): Vàng (gold, Au)
- Kim loại dẫn điện tốt nhất: Bạc (silver, Ag)
- Kim loại dẫn nhiệt tốt nhất: Bạc.
- Kim loại có nhiệt độ nóng chảy cao nhất: Tungsten (W).
- Kim loại có nhiệt độ nóng chảy thấp nhất: Thuỷ ngân (mercury, Hg).
II. Tính chất hóa học của kim loại
1. Tác dụng với phi kim
a) Tác dụng với oxygen
- Hầu hết các kim loại như Ca, Mg, Al, Zn, Fe, Cu,… phản ứng với khí oxyen tạo thành oxide kim loại. Một số kim loại như Au,… không phản ứng với khí oxygen.
Ví dụ:
3Fe + 2O2![]() \(\overset{to}{\rightarrow}\) Fe3O4
\(\overset{to}{\rightarrow}\) Fe3O4
4Al + 3O2 ![]() \(\overset{to}{\rightarrow}\) 2Al2O3
\(\overset{to}{\rightarrow}\) 2Al2O3

- Mở rộng: Một số kim loại như nhôm, kẽm, chromium,… phản ứng được với khí oxygen ngay ở nhiệt độ thường, tạo thành lớp oxide mỏng, bền vững. Lớp oxide này có tác dụng bảo vệ, ngăn không cho kim loại bên trong phản ứng trực tiếp với oxygen.
b) Tác dụng với phi kim khác
- Kim loại có thể tác dụng với nhiều phi kim tạo thành muối.
Ví dụ:
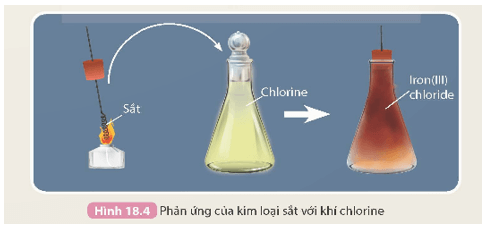
+ Kim loại tác dụng chlorine tạo thành muối chloride
Cu + Cl2 ![]() \(\overset{to}{\rightarrow}\) CuCl2
\(\overset{to}{\rightarrow}\) CuCl2
+ Kim loại tác dụng với lưu huỳnh (sulfur) tạo thành muối sulfide
2Al + 3S![]() \(\overset{to}{\rightarrow}\) Al2S3
\(\overset{to}{\rightarrow}\) Al2S3
2. Tác dụng với nước
- Một số kim loại hoạt động hoá học mạnh như K, Na, Ca,… tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen, phản ứng toả ra nhiều nhiệt.
Ví dụ: 2Na + 2H2O → 2NaOH + H2

- Những kim loại như Zn, Fe,… tác dụng với hơi nước ở nhiệt độ cao tạo thành oxide và khí hydrogen.
Ví dụ: Zn + H2O![]() \(\overset{to}{\rightarrow}\) ZnO + H2
\(\overset{to}{\rightarrow}\) ZnO + H2
- Một số kim loại như Cu, Ag, Au,… không tác dụng với nước, đó là các kim loại hoạt động hoá học yếu.
3. Tác dụng với dung dịch acid
- Một số kim loại phản ứng với dung dịch hydrochloric acid tạo thành muối và giải phóng khí hydrogen.
Ví dụ: Fe + 2HCl → FeCl2 + H2
Iron (II) chloride
2Al + 6HCl → 2AlCl3 + 3H2
Aluminium chloride
- Các kim loại Cu, Ag, Au,… không tác dụng với dung dịch HCl.
4. Tác dụng với dung dịch muối
- Nhiều kim loại như Mg, Al, Zn, Fe,… (trừ kim loại phản ứng được với nước như K, Na, Ca,…) tác dụng được với dung dịch CuSO4, AgNO3,… tạo thành muối mới và kim loại mới.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
Sắt đã đẩy đồng ra khỏi muối, sắt là kim loại hoạt động hoá học mạnh hơn đồng.
>>> Bài tiếp theo: Lý thuyết Khoa học tự nhiên 9 Kết nối tri thức bài 19








