Đề cương ôn thi THPT Quốc gia năm 2017 môn Hóa học
Đề cương ôn thi THPT Quốc gia năm 2017 môn Hóa học
Đề cương ôn thi THPT Quốc gia năm 2017 môn Hóa học gồm lý thuyết môn Hóa học từ lớp 10 đến lớp 12 và một số đề thi thử THPT Quốc gia 2017 môn Hóa có đáp án đi kèm, giúp các bạn luyện tập và củng cố kiến thức môn Hóa hiệu quả.
Bộ đề thi thử THPT Quốc gia năm 2016 môn Hóa học - Số 1
Bộ đề thi thử THPT Quốc gia năm 2016 môn Hóa học - Số 2
Bộ đề thi thử THPT Quốc gia năm 2016 môn Hóa học - Số 3
PHẦN MỘT: ĐỀ CƯƠNG ÔN THI THPT QUỐC GIA
LỚP 10
CHƯƠNG 1: NGUYÊN TỬ
A. KIẾN THỨC CƠ BẢN
1. Thành phần cấu tạo nguyên tử.
- Nguyên tử gồm 2 bộ phận
- Vỏ nguyên tử: gồm các hạt electron mang điện âm (e)
- Hạt nhân:
- Hạt proton mang điện dương (p)
- Hạt nơtron không mang điện (n)
Vậy nguyên tử gồm 3 loại hạt cơ bản: p, n, e.
- Vì nguyên tử luôn trung hòa điện, nên trong nguyên tử: số hạt p = số hạt e.
2. Kích thước, khối lượng của nguyên tử.
Nguyên tử được xem như một khối cầu có đường kính d = 10-10m = 1 Ao
Hạt nhân nguyên tử cũng được xem như là một khối cầu có đường kính d = 10-4
Khối lượng nguyên tử: mnt = ∑mp + ∑mn + ∑me
Vì khối lượng me << mp, mn (mnt = ∑mp + ∑mn = mhn (bằng khối lượng hạt nhân).
mnt = Z.mp + N.mn = Z + N = A (u) vì mp (mn (1u. (Z, N lần lượt là tổng số proton, số nơtron)
(Khi nguyên tử cho hoặc nhận electron để biến thành ion thì khối lượng ion cũng được xem là khối lượng nguyên tử.
3. Đồng vị, khối lượng nguyên tử trung bình.
a) Định nghĩa: Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nghĩa là có cùng số proton nhưng số khối khác nhau (Z giống nhau, A khác nhau dẫn đến N khác nhau).

Trong đó: A1, A2, ..., Ai là số khối của đồng vị thứ 1, 2, ... i.
x1, x2, ..., xi là % số lượng đồng vị thứ i (hoặc là số nguyên tử của đồng vị thứ i), lấy theo thập phân (x1 + x2 + ... + xi = 100% = 1).
VD: Trong thiên nhiên clo có hai đồng vị là 3517Cl chiếm 75% và 3717Cl chiếm 25% về số lượng. Tính khối lượng của nguyên tử Clo?
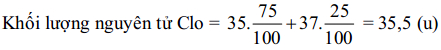
4. Sự sắp xếp electron trong nguyên tử
a) Nguyên tắc sắp xếp:
- Nguyên lý vững bền: Các electron lần lượt chiếm các mức năng lượng từ thấp đến cao
Thứ tự tăng dần mức năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p 5s 5p 4d 6s 4f 5d 6p 7s ...
- Nguyên lý Pauli: Trong một obitan chứa tối đa 2e và 2e này có chiều tự quay ngược nhau.
- Qui tắc Hund: Trong một phân lớp chưa đủ số electron, các electron có khuynh hướng phân bố vào các obitan sao cho số electron độc thân trong một phân lớp nhiều nhất.
b) Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
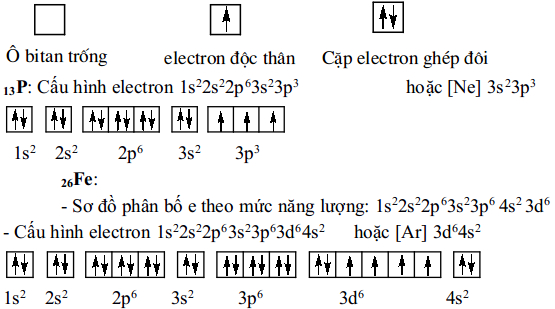
Cấu hình electron còn được viết dưới dạng ô lượng tử
Mỗi ô lượng tử biểu diễn bằng một ô vuông thay cho một obitan; mỗi electron biểu diễn bằng một mũi tên. Một ô đã có đủ 2 electron, người ta nói rằng một cặp electron đã ghép đôi. Nếu một ô chỉ có 1 electron thì đó là electron độc thân.
Lưu ý: Một số trường hợp đặc biệt, nếu nguyên tử có cấu hình electron lớp ngoài (n-1)dansb (n: số thứ tự lớp ngoài cùng).
- Nếu a + b = 6 (a = 5; b = 1.
- Nếu a + b = 11 (a = 10; b = 1.
Ví dụ: 24Cr: 1s22s22p63s23p63d54s1 hay [Ar] 3d54s1
29Cr: 1s22s22p63s23p63d104s1 hay [Ar] 3d104s1
5. Đặc điểm của lớp electron ngoài cùng
Đối với nguyên tử của tất cả các nguyên tố, lớp ngoài cùng có tối đa là 8 electron.
Các nguyên tử có 8 electron lớp ngoài cùng đều rất bền vững, chúng hầu như không tham gia vào phản ứng hóa học. Đó là các nguyên tử khí hiếm (hay khí trơ), hoặc He có 2 electron lớp ngoài cùng cũng rất bền vững.
Các nguyên tử có 1, 2, 3 electron lớp ngoài cùng đều là những kim loại (trừ B)
Các nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là những phi kim.
Các nguyên tử có 4 electron lớp ngoài cùng có thể là phi kim (nếu thuộc chu kì nhỏ) hoặc kim loại (nếu thuộc chu kì lớn).
Các electron lớp ngoài cùng quyết định hầu hết các tính chất hóa học của một nguyên tố. Do đó có thể dự đoán tính chất hóa học cơ ban của một nguyên tử nếu biết được sự phân bố electron trong nguyên tử của nguyên tố đó.
Đề cương ôn thi THPT Quốc gia năm 2016 môn Sinh học
Đề cương ôn thi THPT Quốc gia năm 2016 môn Toán
B. Bài tập minh họa ôn thi THPT Quốc gia 2017 môn Hóa học
B1. Cấp độ biết (5 câu)
Câu 1: Trong nguyên tử, hạt mang điện là
A. electron. B. electron và nơtron C. proton và nơtron D. proton và electron.
Câu 2: Số khối của nguyên tử bằng tổng
A. số proton và nơtron. B. số proton và electron
C. số nơtron, electron và proton. D. số điện tích hạt nhân.
Câu 3: Nguyên tố hóa học là tập hợp những nguyên tử có cùng
A. số khối. B. điện tích hạt nhân
C. số nơtron D. tổng số proton và nơtron
Câu 4: Chọn cấu hình electron đúng ở trạng thái cơ bản?
A. 1s22s22p63p2. B. 1s22s22p63s2.
C. 1s22s22p53s3 D. 1s22s22p63s13p1.
Câu 5: Phân lớp s, p, d lần lượt đầy điện tử (bão hòa) khi có số electron là
A. 1, 3, 5. B. 2, 4, 6. C. 1, 2, 3. D. 2, 8, 18.
B2. Cấp độ hiểu (5 câu)
Câu 6: Cấu hình electron của nguyên tử có số hiệu bằng 17 là
A. 1s22s22p63s23p44s1 B. 1s22s22p63s23d5
C. 1s22s22p63s23p5 D. 1s22s22p63s23p34s2
Câu 7: Các ion sau: 802-, 12Mg2+, 13Al3+ bằng nhau về
A. Số khối B. Số nơtron C. Số proton D. Số electron
Câu 8: Cation M2+ có cấu hình electron phân lớp ngoài cùng là 2p6, cấu hình electron của nguyên tử M là
A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s22p63s2 D. 1s22s22p4
(Còn tiếp)


