Đề thi giữa kì 1 KHTN 8 Kết nối tri thức - Đề 3
Đề kiểm tra giữa kì 1 Khoa học Tự nhiên 8 KNTT - đề số 3 kèm theo đáp án và ma trận được biên soạn nhằm hỗ trợ thầy cô và học sinh trong quá trình dạy – học. Đề thi kèm theo ma trận và đáp án chi tiết không chỉ giúp giáo viên dễ dàng tham khảo khi ra đề, mà còn tạo điều kiện để học sinh tự rèn luyện, kiểm tra, và củng cố kiến thức hiệu quả.
Hy vọng tài liệu này sẽ là nguồn tham khảo hữu ích, góp phần nâng cao chất lượng học tập và giúp các em tự tin hơn khi bước vào kỳ kiểm tra.
Đề thi giữa kì 1 Khoa học tự nhiên 8 KNTT
A. PHẦN TRẮC NGHIỆM (4 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: (NB) Dụng cụ dưới đây gọi là gì?
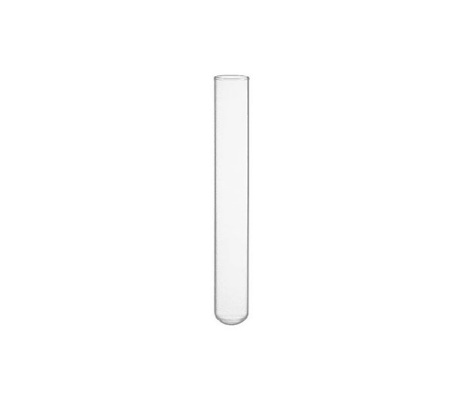
A. Bình cầu
B. Cốc thủy tinh.
C. Ống đong.
D. Ống nghiệm.
Câu 2: (TH) Chọn đáp án đúng cho ý nghĩa của kí hiệu sau.

A. Cảnh báo khu vực hay có sét đánh
B. Nguy hiểm về điện
C. Khu vực có chất độc sinh học
D. Cảnh báo chất độc
Câu 3: (NB) Quá trình biến đổi hóa học là
A. quá trình mà chất chỉ chuyển từ trạng thái này sang trạng thái khác, không tạo thành chất mới.
B. quá trình chất biến đổi có sự tạo thành chất mới.
C. quá trình chất biến đổi có sự tạo thành chất mới hoặc không tạo thành chất mới.
D. quá trình chất không biến đổi và không có sự hình thành chất mới.
Câu 4: (NB) Bản chất của phản ứng hóa học là sự thay đổi về
A. số lượng nguyên tử mỗi nguyên tố.
B. số lượng các nguyên tố.
C. số lượng các phân tử.
D. liên kết giữa các nguyên tử.
Câu 5: (NB) Chọn từ còn thiếu vào chỗ trống:
“Trong một phản ứng hóa học, …(1) … khối lượng của các sản phẩm bằng …(2)… khối lượng của các chất phản ứng.”
A. (1) tổng, (2) tích
B. (1) tích, (2) tổng
C. (1) tổng, (2) tổng
D. (1) tích, (2) tích
.....................
B. PHẦN TỰ LUẬN (6 điểm)
Câu 1. (1,5 điểm)
(NB) Hãy nêu các yếu tố làm thay đổi tốc độ phản ứng.
Câu 2. (2 điểm)
1) (NB) Hãy cho biết các nguyên tố dinh dưỡng có trong phân đạm, phân lân, phân kali, phân NPK.
2) (TH) Cho các oxide sau: CaO, CO2, CO.
· Oxide nào có thể tác dụng được với HCl.
· Oxide nào có thể tác dụng được với NaOH.
Viết phương trình hóa học và phân loại các oxide trên.
3) (VDC) Để hòa tan vừa hết 6,72 gam Fe phải dùng bao nhiêu ml hỗn hợp dung dịch HCl 0,2M và H2SO4 0,5M?
....................................
Trên đây là một phần của Đề số 3 đề thi giữa kì 1 môn Khoa học tự nhiên 8 - sách Kết nối tri thức, để xem trọn bộ tài liệu này mời các bạn kích vào nút Tải về dưới đây.






