Sơ lược phương pháp giải Toán hỗn hợp chất khử tác dụng với H+ và No3-
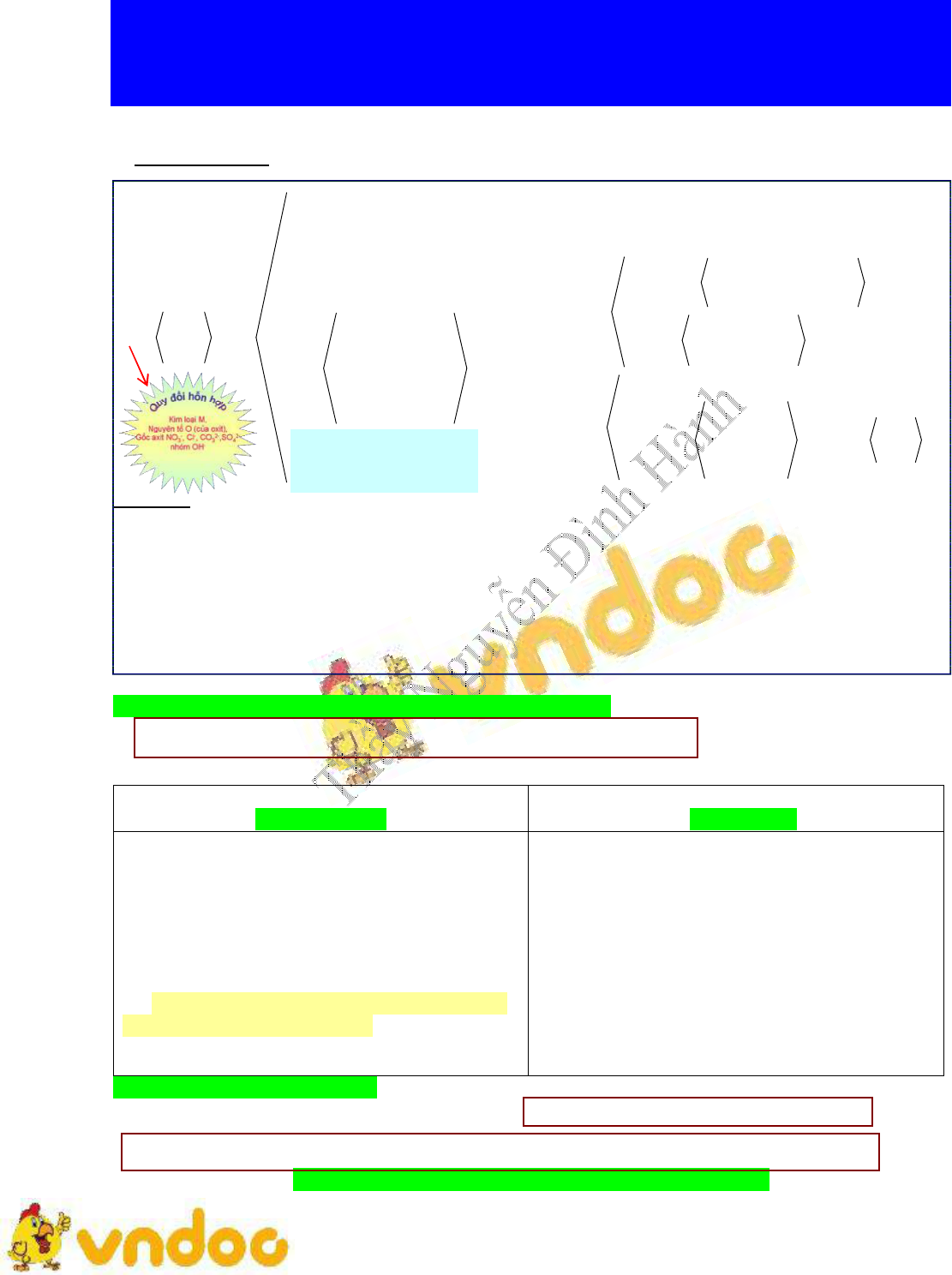

Sơ lược phương pháp giải Toán hỗn hợp chất khử tác dụng với H+ và No3- lớp 8
Sơ lược phương pháp giải Toán hỗn hợp chất khử tác dụng với H+ và No3- được VnDoc sưu tầm và đăng tải. Đây là tài liệu hay dành cho quý thầy cô cùng các bạn học sinh ôn tập, chuẩn bị tốt bài giảng trước khi đến lớp. Mời các quý thầy cô cùng các bạn học sinh tham khảo
- Phản ứng hóa học của Mangan (Mn) và Hợp chất của Mangan - Cân bằng phương trình hóa học
- Phản ứng hóa học của Vàng (Au) và Hợp chất của Vàng - Cân bằng phương trình hóa học
- Phản ứng hóa học của Crom (Cr) và Hợp chất của Crom - Cân bằng phương trình hóa học
............................................
Ngoài Sơ lược phương pháp giải Toán hỗn hợp chất khử tác dụng với H+ và No3-. Mời các bạn học sinh còn có thể tham khảo các đề thi học kì 1 lớp 8, đề thi học kì 2 lớp 8 các môn Toán, Văn, Anh, Lý, Địa, Sinh mà chúng tôi đã sưu tầm và chọn lọc. Với tài liệu lớp 8 sẽ giúp các bạn ôn tập tốt hơn. Chúc các bạn học tập tốt



