Chất ban đầu bị biến đổi trong quá trình phản ứng
Chất ban đầu bị biến đổi trong quá trình phản ứng được gọi là
Chất ban đầu bị biến đổi trong quá trình phản ứng được gọi là chất phản ứng hay chất tham gia.
Vndoc.com xin gửi tới bạn đọc Đề khảo sát chất lượng môn Khoa học tự nhiên tháng 9, cùng nhau luyện tập và xem kết quả nha!
Chất ban đầu bị biến đổi trong quá trình phản ứng
Chất ban đầu bị biến đổi trong quá trình phản ứng được gọi là
Chất ban đầu bị biến đổi trong quá trình phản ứng được gọi là chất phản ứng hay chất tham gia.
Đun nóng hóa chất bằng ống nghiệm
Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng bao nhiêu so với ống nghiệm tính từ miệng ống?
Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng 1/3 so với ống nghiệm tính từ miệng ống.
Điều kiện nhiệt độ và áp suất của điều kiện chuẩn
Điều kiện chuẩn có nhiệt độ và áp suất có giá trị là
Điều kiện chuẩn có nhiệt độ và áp suất có giá trị là 25oC và 1 bar.
Thể tích của 0,5 mol khí SO2 ở điều kiện chuẩn
Thể tích của 0,5 mol khí SO2 ở điều kiện chuẩn là
Thể tích của 1 mol khí SO2 ở điều kiện chuẩn là 24,479 lít.
Thể tích của 0,5 mol khí SO2 ở điều kiện chuẩn là 0,5.24,479 = 12,395 (lít).
Tính số loại phản ứng cần cung cấp năng lượng
Cho các loại phản ứng: phản ứng tạo gỉ kim loại, phản ứng quang hợp, phản ứng nhiệt phân, phản ứng đốt cháy. Trong các loại phản ứng trên, có bao nhiêu loại cần cung cấp năng lượng trong quá trình phản ứng?
Có 3 loại phản ứng cần cung cấp năng lượng trong quá trình phản ứng là: phản ứng quang hợp, phản ứng nhiệt phân, phản ứng đốt cháy.
Các nguyên tố hóa học tạo nên nước
Nước được tạo ra từ nguyên tử của các nguyên tố hóa học nào?
Nước có công thức hóa học là H2O ⇒ Nước được tạo ra từ 2 nguyên tử nguyên tố H và 1 nguyên tử nguyên tố O.
Xác định khí X
Khí X có tỉ khối so với H2 là 32. Khí X là khí nào trong số các khí sau?
Theo bài ra ta có:
Vậy khí X là SO2.
Khối lượng trước và sau một phản ứng được bảo toàn
Tổng khối lượng của các chất trước và sau một phản ứng hóa học được bảo toàn vì
Trong phản ứng hóa học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử, số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi, khối lượng nguyên tử không thay đổi. Vì vậy, tổng khối lượng của các chất được bảo toàn.
Số Avogadro
Số Avogadro có giá trị là
Số Avogadro có giá trị là 6,022.1023.
Quá trình biến đổi hóa học
Quá trình biến đổi hóa học là
Quá trình biến đổi hóa học là quá trình chất biến đổi có sự tạo thành chất mới.
Khối lượng của 0,2 mol Na2O
Khối lượng của 0,2 mol Na2O là
Khối lượng của 0,2 mol Na2O là 0,2.62 = 12,4 gam.
Khí có thể thu được vào lọ bằng phương pháp đẩy không khí
Khí có thể thu được vào lọ bằng phương pháp đẩy không khí như mô tả ở hình bên là
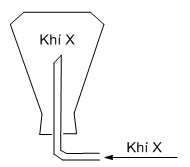
Khí có thể thu được vào lọ bằng phương pháp đẩy không khí phải nhẹ hơn không khí.
Trong các khí trên, khí thỏa mãn là H2.
Lượng chất chứa nhiều số mol nhất
Lượng chất nào sau đây chứa số mol nhiều nhất?
Vậy ta thấy 4 gam O2 chứa nhiều số mol nhất.
Xác định khối lượng mol của khí A
Biết tỉ khối của khí B so với oxygen là 0,5 và tỉ khối của khí A so với khí B là 2,125. Xác định khối lượng mol của khí A.
Theo bài ra ta có:
Lại có:
Vậy khối lượng mol của khí A là 34 g/mol.
Cách xử lí đúng hóa chất còn thừa sau khi dùng xong
Cách xử lí đúng hóa chất còn thừa sau khi dùng xong là
Cách xử lí đúng hóa chất còn thừa sau khi dùng xong là xử lí theo hướng dẫn giáo viên.
Quá trình hòa tan đường vào nước
Hòa tan đường vào nước là
Hòa tan đường vào nước là biến đổi vật lí.
Tính số mol khí H2 thu được sau phản ứng
Cho 6,5 gam Zn phản ứng với HCl loãng, dư thu được muối ZnCl2 và khí H2. Số mol khí H2 thu được ở đkc sau phản ứng là
Phương trình phản ứng:
Zn + 2HCl → ZnCl2 + H2
Từ phương trình hóa học ta thấy: nH2 = nZn = 0,1 (mol)
Tổng hệ số các chất sản phẩm
Cho sơ đồ phản ứng sau:
FexOy + H2 Fe + H2O
Tổng hệ số các chất sản phẩm là
Sơ đồ phản ứng sau:
FexOy + H2 Fe + H2O
So sánh số nguyên tử của mỗi nguyên tố và cân bằng:
- Thêm hệ số x và trước Fe để cân bằng số nguyên tử Fe.
FexOy + H2 xFe + H2O
- Thêm hệ số y vào trước H2O để cân bằng số nguyên tử O.
FexOy + H2 xFe + yH2O
Thêm hệ số y vào trước H2 để cân bằng số nguyên tử H.
FexOy + yH2 xFe + yH2O
Phương trình phản ứng sau cân bằng là: FexOy + H2 → xFe + yH2O.
Vậy tổng hệ số các chất sản phẩm là: x + y.
Ứng dụng không có của phản ứng tỏa nhiệt
Trong sản xuất và đời sống, các phản ứng toả nhiệt không có ứng dụng nào trong các ứng dụng sau?
Ứng dụng không phải của phản ứng toả nhiệt: Cung cấp năng lượng cho động cơ điện.
Tính a
Đốt cháy 1,2 gam carbon cần a gam oxygen, thu được 4,4 gam khí carbon dioxide. Tính a.
Phương trình hóa học:
C + O2 → CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mC + mO2 = mCO2
⇒ 1,2 + mO2 = 4,4
⇒ mO2 = 4,4 - 1,2 = 3,2 (g)
Ở mỗi phát biểu hãy chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(1) Quá trình cho vôi sống (CaO) vào nước tạo thành nước vôi trong (Ca(OH)2) là sự biến đổi vật lí. Sai || Đúng
(2) Giũa thanh sắt thu được mạt sắt là sự biến đổi vật lí. Đúng || Sai
(3) Trứng gà (vịt) để lâu ngày bị ung là sự biến đổi hoá học. Đúng || Sai
(4) Quá trình chuyển hoá lipid (chất béo) trong cơ thể người thành glycerol và acid béo là sự biến đổi vật lí. Sai || Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(1) Quá trình cho vôi sống (CaO) vào nước tạo thành nước vôi trong (Ca(OH)2) là sự biến đổi vật lí. Sai || Đúng
(2) Giũa thanh sắt thu được mạt sắt là sự biến đổi vật lí. Đúng || Sai
(3) Trứng gà (vịt) để lâu ngày bị ung là sự biến đổi hoá học. Đúng || Sai
(4) Quá trình chuyển hoá lipid (chất béo) trong cơ thể người thành glycerol và acid béo là sự biến đổi vật lí. Sai || Đúng
Biến đổi vật lí là hiện tượng có sự biến đổi về trạng thái, kích thước,... nhưng vẫn giữ nguyên là chất ban đầu.
Biến đổi hóa học là hiện tượng chất có sự biến đổi tạo ra chất khác.
Vậy:
(1) sai. Có sự tạo thành chất mới ⇒ quá trình này là biến đổi hoá học.
(2) đúng. Không có sự tạo thành chất mới ⇒ quá trình này là biến đổi vật lí.
(3) đúng. Có sự tạo thành chất mới ⇒ quá trình này là biến đổi hoá học.
(4) sai. Có sự tạo thành chất mới ⇒ quá trình này là biến đổi hoá học.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Đá viên tan chảy là quá trình tỏa nhiệt. Sai || Đúng
(b) Nước bay hơi là quá trình tỏa nhiệt. Đúng || Sai
(c) Xăng cháy trong không khí là quá trình thu nhiệt. Sai || Đúng
(d) Nướng bánh là quá trình thu nhiệt. Đúng || Sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Đá viên tan chảy là quá trình tỏa nhiệt. Sai || Đúng
(b) Nước bay hơi là quá trình tỏa nhiệt. Đúng || Sai
(c) Xăng cháy trong không khí là quá trình thu nhiệt. Sai || Đúng
(d) Nướng bánh là quá trình thu nhiệt. Đúng || Sai
(a) sai. Đá viên tan chảy là quá trình thu nhiệt.
(b) đúng.
(c) sai. Xăng cháy trong không khí là quá trình tỏa nhiệt.
(d) đúng.
Ở mỗi ý a), b), c), d) chọn đúng hoặc sai
Cho phương trình hóa học của phản ứng sau:
Fe + 2HCl → FeCl2 + H2
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
a) FeCl2 là chất tham gia phản ứng. Sai || Đúng
b) Phương trình bảo toàn khối lượng của các chất trong phản ứng là: mFe + mHCl = mFeCl2 + mH2. Đúng || Sai
c) Cứ 2 mol HCl phản ứng tạo thành 1 mol H2. Đúng || Sai
d) Tổng hệ số các chất sản phẩm trong phương trình hóa học là 5. Sai || Đúng
Cho phương trình hóa học của phản ứng sau:
Fe + 2HCl → FeCl2 + H2
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
a) FeCl2 là chất tham gia phản ứng. Sai || Đúng
b) Phương trình bảo toàn khối lượng của các chất trong phản ứng là: mFe + mHCl = mFeCl2 + mH2. Đúng || Sai
c) Cứ 2 mol HCl phản ứng tạo thành 1 mol H2. Đúng || Sai
d) Tổng hệ số các chất sản phẩm trong phương trình hóa học là 5. Sai || Đúng
(a) sai. FeCl2 là chất sản phẩm.
(b) đúng.
(c) đúng.
(d) sai. Tổng hệ số các chất sản phẩm trong phương trình hóa học là 1 + 1 = 2.
Ở mỗi ý a), b), c), d) hãy chọn đúng hoặc sai
Ở mỗi ý a), b), c), d) hãy chọn đúng hoặc sai.
Một hợp chất khí A có công thức hóa học là XO2, có khối lượng mol phân tử là 46 gam/mol.
a) Thể tích của 1 mol khí A ở điều kiện chuẩn là 24,79 lít. Đúng || Sai
b) 0,25 mol khí A có khối lượng là 11,5 gam. Đúng || Sai
c) Tỉ khối của khí A đối với không khí là 2,586. Sai || Đúng
d) X là nguyên tố carbon (C). Sai || Đúng
Ở mỗi ý a), b), c), d) hãy chọn đúng hoặc sai.
Một hợp chất khí A có công thức hóa học là XO2, có khối lượng mol phân tử là 46 gam/mol.
a) Thể tích của 1 mol khí A ở điều kiện chuẩn là 24,79 lít. Đúng || Sai
b) 0,25 mol khí A có khối lượng là 11,5 gam. Đúng || Sai
c) Tỉ khối của khí A đối với không khí là 2,586. Sai || Đúng
d) X là nguyên tố carbon (C). Sai || Đúng
a) đúng. Thể tích của 1 mol khí A ở đkc là V = 1.24,79 = 24,79 (l).
b) đúng. mA = 0,25.46 = 11,5 (g)
c) sai. Tỉ khối của A đối với không khí là: dA/KK = 46/29 = 1,856.
d) sai. Khối lượng mol phân tử X là: MX + 2.16 = 44.
⇒ MX = 46 – 16.2 = 14 (gam/mol).
Vậy X là nguyên tố nitrogen (N).
Chỉ ra sự biến đổi vật lí và sự biến đổi hóa học
Dây tóc trong bóng đèn nóng đỏ và phát sáng mỗi khi có dòng điện đi qua. Trường hợp bóng đèn bị nứt và không khí (có khí oxygen) chui vào bên trong thì dây tóc bị cháy khi bật công tắc điện. Hãy phân tích và chỉ ra khi nào xảy ra sự biến đổi vật lí, khi nào xảy ra sự biến đổi hóa học.
Dây tóc trong bóng đèn nóng đỏ và phát sáng mỗi khi có dòng điện đi qua. Trường hợp bóng đèn bị nứt và không khí (có khí oxygen) chui vào bên trong thì dây tóc bị cháy khi bật công tắc điện. Hãy phân tích và chỉ ra khi nào xảy ra sự biến đổi vật lí, khi nào xảy ra sự biến đổi hóa học.
- Biến đổi vật lí xảy ra khi dòng điện chạy qua dây tóc bóng đèn điện nóng đỏ phát sáng.
- Biến đổi hóa học xảy ra khi bóng đèn điện nứt và không khí chui vào bên trong thì dây tóc bóng đèn bị cháy khi bật công tắc điện.
Lập phương trình hóa học của phản ứng
Cho sơ đồ của các phản ứng sau: K + O2 ![]() K2O.
K2O.
Lập phương trình hóa học của phản ứng và cho biết tỉ lệ số nguyên tử, số phân tử của hai cặp chất trong phản ứng (tùy chọn).
Cho sơ đồ của các phản ứng sau: K + O2 ![]() K2O.
K2O.
Lập phương trình hóa học của phản ứng và cho biết tỉ lệ số nguyên tử, số phân tử của hai cặp chất trong phản ứng (tùy chọn).
Sơ đồ phản ứng: K + O2 K2O.
So sánh số nguyên tử của mỗi nguyên tố và cân bằng:
| K + | O2 | K2O | |
| 1 | 2 | 2 1 |
Thêm hệ số 2 vào trước K2O để cân bằng số nguyên tử O.
| K + | O2 | 2K2O | |
| 1 | 2 | 4 2 |
Thêm hệ số 4 vào trước K để cân bằng số nguyên tử K.
| 4K + | O2 | 2K2O | |
| 4 | 2 | 4 2 |
Viết phương trình: 4K + O2 → 2K2O
Số nguyên tử K : số phân tử O2 = 4 : 1
Số nguyên tử K : số phân tử K2O = 4 : 2 = 2 : 1
Thể tích dung dịch đựng trong ống đong
Thể tích dung dịch đựng trong ống đong dưới đây là bao nhiêu?
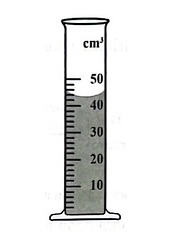
Thể tích dung dịch đựng trong ống đong dưới đây là bao nhiêu?

Thể tích dung dịch đựng trong ống đong trên là 44 cm3 hay 44 ml.
Tính tỉ khối với không khí của các khí
Tính tỉ khối với không khí của các khí sau: H2, CO2.
Tính tỉ khối với không khí của các khí sau: H2, CO2.
- Khí H2:
- Khí CO2:
Tính thể tích ở 25oC, 1 bar của các lượng khí
Tính thể tích ở 25oC, 1 bar của những lượng khí sau:
a) 1,5 mol khí N2.
b) 3,011.1022 phân tử H2.
Tính thể tích ở 25oC, 1 bar của những lượng khí sau:
a) 1,5 mol khí N2.
b) 3,011.1022 phân tử H2.
a. Thể tích của 1,5 mol khí N2 là: V = 1,5.24,79 = 37,185 (l)
b. 1 mol phân tử H2 chứa 6,022.1023 phân tử H2.
→ x mol phân tử H2 chứa 3,011.1022 phân tử H2.
Thể tích của lượng khí là: V = 0,05.24,79 = 1,2395 (lít)
Tính hiệu suất của phản ứng
Đốt 16 lít khí CO trong bình với 6 lít O2. Sau phản ứng thu được 18 lít hỗn hợp khí. Tính hiệu suất của phản ứng.
Đốt 16 lít khí CO trong bình với 6 lít O2. Sau phản ứng thu được 18 lít hỗn hợp khí. Tính hiệu suất của phản ứng.
Phương trình phản ứng:
2CO + O2 2CO2
Ta có: > 6 → Hiệu suất tính theo O2.
Theo phương trình:
VCO p/ư = x (L); VO2 p/ư = 0,5x (L)
⇒ VCO dư = 16 − x (L); VO2 dư = 6 − 0,5x (L)
⇒ Vsau = 16 − x + 6 − 0,5x + x = 18
⇒ x = 8
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

