Đề kiểm tra học kì 1 môn Hóa học lớp 11 năm học 2014 - 2015 trường THPT Châu Thành 1, Đồng Tháp
Đề kiểm tra học kì 1 môn Hóa học lớp 11
Đề kiểm tra học kì 1 môn Hóa học lớp 11 năm học 2014 - 2015 trường THPT Châu Thành 1, Đồng Tháp bao gồm đề thi cùng đáp án đi kèm, đây là tài liệu ôn tập hữu ích dành cho các bạn học sinh lớp 11, giúp các bạn chuẩn bị thi học kì 1 môn Hóa một cách chủ động và hiệu quả. Mời các bạn tham khảo.
Đề kiểm tra học kì 1 môn Hóa học lớp 11 năm học 2014 - 2015 trường THPT Quỳnh Lưu 2, Nghệ An
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO TỈNH ĐỒNG THÁP
ĐỀ CHÍNH THỨC (Đề gồm có 01 trang) |
KIỂM TRA HỌC KÌ I Năm học: 2014-2015 Môn thi: HÓA HỌC - Lớp 11 Ngày thi: 24/ 12/ 2014 Thời gian: 45 phút (không kể thời gian phát đề) |
I. PHẦN CHUNG CHO TẤT CẢ THÍ SINH (8,0 điểm)
Câu 1: (2,0 điểm) Viết phương trình hóa học dạng phân tử và ion rút gọn (nếu có) xảy ra trong dung dịch giữa các cặp chất sau:
a./ HCl + Na2CO3
b./ Fe(OH)3 (r) + HNO3
Câu 2: (1,0 điểm) Viết phương trình phân tử ứng với phương trình ion rút gọn sau:
a./ 3Ca2+ + 2PO43- → Ca3(PO4)2
b./ NH4+ + OH- → NH3 ↑ + H2O
Câu 3: (2,0 điểm) Viết phương trình hóa học thực hiện chuỗi phản ứng sau:
![]()
Câu 4: (2,0 điểm) Cho 21,9g hỗn hợp kim loại gồm nhôm và đồng tác dụng hoàn toàn với HNO3 loãng thì thu được 6,72 lít (đo ở đktc) một chất khí không màu sau đó hóa nâu trong không khí (là sản phẩm khử duy nhất).
a. Viết các phương trình phản ứng xảy ra.
b. Tính thành phần phần trăm về khối lượng của các kim loại trong hỗn hợp
(cho Al = 27, Cu = 64, N = 14, O = 16, H = 1)
Câu 5: (1,0 điểm) Trộn 0,65 lít dung dịch HCl có pH = 1 với 0,35 lit dung dịch NaOH 0,1M ta được dung dịch A. Tính pH của dung dịch A?
II. PHẦN RIÊNG - Tự chọn (2,0 điểm)
Thí sinh chỉ chọn một trong hai câu (câu 6.a hoặc câu 6.b)
Câu 6.a. Theo chương trình Chuẩn (2,0 điểm)
Bằng phương pháp hoá học hãy phân biệt các dung dịch mất nhãn chứa trong các lọ riêng biệt sau:
(NH4)2SO4, K2SO4, NaCl, NaNO3
Câu 6.b. Theo chương trình Nâng cao (2,0 điểm)
Chỉ dùng thêm quỳ tím, hãy phân biệt các dung dịch mất nhãn chứa trong các lọ riêng biệt sau:
NH4Cl, Ba(OH)2, (NH4)2SO4, NaNO3
Đáp án đề kiểm tra học kì 1 môn Hóa học lớp 11
Câu 1 (2,0 điểm)
a./ 2HCl + Na2CO3 → CO2 + H2O + 2NaCl
2H+ + CO32- → CO2 + H2O
b./ Fe(OH)3 (r) + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 (r) + 3H+ → Fe3+ + 3H2O
Câu 2: (1,0 điểm)
a./ 3CaCl2 + 2Na3PO4 → Ca3(PO4)2 + 6NaCl
b./ NH4Cl + NaOH → NaCl + NH3 + H2O
Câu 3: (2,0 điểm)
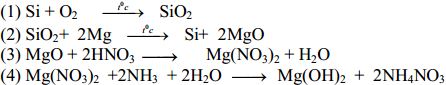
Câu 4: (2,0 điểm)
a./ Al + 4HNO3 → Al(NO3)3 + NO + 2H2O.
3Cu+ 8HNO3 → 3Cu(NO3)2 + 2NO + 4 H2O
b./ Al + 4HNO3 → Al(NO3)3 + NO + 2H2O.
x 4x x x
3Cu+ 8HNO3 → 3Cu(NO3)2 + 2NO + 4 H2O
y 8y/3 y 2y/3
nNO = 6,72 / 22,4 = 0,3 mol
x + 2y/3 = 0,3 (1)
27x + 64y = 21,9 (2)
x = 0,1; y = 0,3
m Al = 0,1 x 27 = 2,7 (g)
→ % Al = (2,7x100) / 21,9 = 12,33%
→ % Cu = 100-12,33 = 87,67%
Câu 5: (1,0 điểm)
* pH = 1 → [H+] = 10-1M
HCl → H+ + Cl-
→ nHCl = nH+ = 0,1. 0,65 = 0,065 mol
nNaOH = nOH- = 0,1. 0,35 = 0,035 mol
HCl + NaOH → NaCl + H2O
0,035 0,035
Số mol HCl dư: 0,065 - 0,035 = 0,03 mol
Σ V = 0,35 + 0,65 = 1 lit
[H+] = 0,03 : 1= 0,03M
pH = - lg (0,03) = 1,52
Câu 6.a. Theo chương trình Chuẩn (2,0 điểm)
- Lấy mẫu thử
- Dùng dung dịch NaOH nhận được (NH4 )2SO4: có khí thoát có mùi khai và làm xanh quì tím ẩm
(NH4 )2SO4 + 2NaOH → Na2SO4 + 2NH3 ↑ + 2H2O
- Dùng dung dịch BaCl2 nhận K2SO4: có kết tủa trắng
K2SO4 + BaCl2 → BaSO4 ↓ + 2KCl
- Dùng dung dịch AgNO3 nhận NaCl: có kết tủa trắng
NaCl + AgNO3→ AgCl ↓ + NaNO3
- Còn lại NaNO3 không hiện tượng
Câu 6.b. Theo chương trình Nâng cao (2,0 điểm)
- Lấy mẫu thử
- Dùng quỳ tím nhận
- Hóa đỏ NH4Cl, (NH4)2SO4
- Hóa xanh Ba(OH)2
- Không đổi màu NaNO3
- Dùng dung dịch Ba(OH)2 vừa nhận được để nhận nhóm NH4 Cl, (NH4)2SO4:
- có khí thoát ra làm xanh quì tím ẩm là NH4Cl
2 NH4 Cl + Ba(OH)2 → BaCl2 + 2NH3 ↑ +2 H2O
- có khí thoát ra làm xanh quì tím ẩm và có kết tủa trắng là (NH4)2SO4
(NH4)2 SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3 ↑ + 2 H2O



