Lý thuyết Hóa học 10 bài 14 CTST
Chúng tôi xin giới thiệu bài Lý thuyết Hóa lớp 10 bài 14: Tính biến thiên Enthalpy của phản ứng hóa học được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Tính biến thiên Enthalpy của phản ứng hóa học
A. Lý thuyết Hóa học 10 bài 14
1. Xác định biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết
- Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
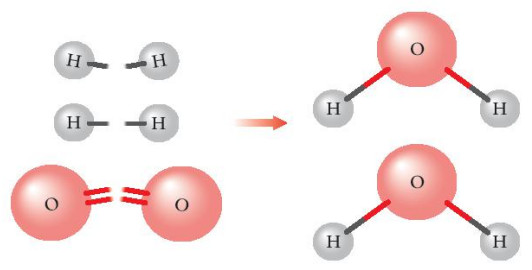
Hình 14.1. Sự hình thành phân tử nước
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
- Cho phản ứng tổng quát ở điều kiện chuẩn: aA (g) + bB (g) → mM (g) + nN (g)
- Tính ![]() \({\Delta _r}H_{298}^0\) của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
\({\Delta _r}H_{298}^0\) của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
![]() \({\Delta _r}H_{298}^0\)= a x Eb (A) + b x Eb (B) – m x Eb (M) - n x Eb (N) (1)
\({\Delta _r}H_{298}^0\)= a x Eb (A) + b x Eb (B) – m x Eb (M) - n x Eb (N) (1)
- Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
Bảng 14.1. Năng lượng liên kết của một số liên kết cộng hoá trị
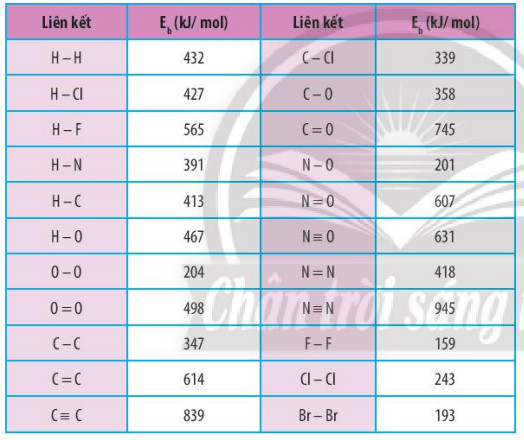
Ví dụ 1: Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
- Bước 1: Tính năng lượng cần thiết để phá vỡ 1 mol H - H và 1 mol Cl - Cl
+ Tổng năng lượng thu vào để phá vỡ các liên kết: Eb (H -H) + Eb (C - C) = 432 +243 = 675 kJ
- Bước 2: Tính năng lượng toả ra khi hình thành 2 mol H - Cl
+ Tổng năng lượng toả ra để hình thành liên kết: 2 x Eb (H-Cl) = 2 x 427 = 854 kJ
- Bước 3: Tính biến thiên enthalpy của phản ứng theo công thức (1)
+ ![]() \({\Delta _r}H_{298}^0\) = 675 - 854 = -179 kJ
\({\Delta _r}H_{298}^0\) = 675 - 854 = -179 kJ
+ Do ![]() \({\Delta _r}H_{298}^0\)< 0 nên phản ứng tỏa nhiệt.
\({\Delta _r}H_{298}^0\)< 0 nên phản ứng tỏa nhiệt.
Ví dụ 2: Tính biến thiên enthanny của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết ở Bảng 14.1). Cho biết phản ứng thu nhiệt hay tỏa nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
3H2(g) + N2(g) → 2NH3 (g)
![]() \({\Delta _r}H_{298}^0\) = 3 x Eb (H2) + Eb (N2) - 2 x Eb (NH3)
\({\Delta _r}H_{298}^0\) = 3 x Eb (H2) + Eb (N2) - 2 x Eb (NH3)
= 3 x Eb(H - H) + Eb(N - N) – 2 x 3 x Eb(N - H) = 3 x 432 + 945 - 2 x 3 x 391 = -105 kJ.
- Do ![]() \({\Delta _r}H_{298}^0\) < 0 nên phản ứng tỏa nhiệt.
\({\Delta _r}H_{298}^0\) < 0 nên phản ứng tỏa nhiệt.
- Sơ đồ biểu diễn biến thiên enthalpy của phản ứng:
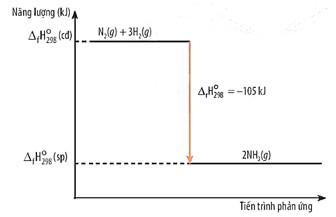
Hình 14.2.Sơ đồ biểu diễn biến thiên enthalpy
|
Tổng quát: Với |
|---|
2. Xác định biến thiên Enthalpy của phản ứng dựa vào Enthalpy
- Tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
- Cho phương trình hoá học tổng quát: aA + bB → MM + nN
- Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hoá học ![]() \(({\Delta _r}H_{298}^0)\) khi biết các giá trị
\(({\Delta _r}H_{298}^0)\) khi biết các giá trị ![]() \({\Delta _f}H_{298}^0\) của tất cả các chất đầu và sản phẩm theo công thức sau:
\({\Delta _f}H_{298}^0\) của tất cả các chất đầu và sản phẩm theo công thức sau:
![]() \({\Delta _r}H_{298}^0 = m.{\Delta _f}H_{298}^0(M) + n.{\Delta _f}H_{298}^0(N) - a.{\Delta _f}H_{298}^0(A) - b.{\Delta _f}H_{298}^0(B) (2)\)
\({\Delta _r}H_{298}^0 = m.{\Delta _f}H_{298}^0(M) + n.{\Delta _f}H_{298}^0(N) - a.{\Delta _f}H_{298}^0(A) - b.{\Delta _f}H_{298}^0(B) (2)\)
Ví dụ 3: Cho enthalpy tạo thành chuẩn của các chất tương ứng trong phương trình.
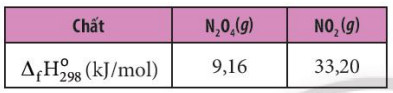
- Tính biến thiên enthalpy của phản ứng sau: 2NO2 (g) → N2O4 (g)
- Theo công thức (2), ta có:
![]() \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}{O_4}) - 2.{\Delta _f}H_{298}^0(N{O_2})\)= 9,16 – 2 x 33,20 = -57,24 kg
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}{O_4}) - 2.{\Delta _f}H_{298}^0(N{O_2})\)= 9,16 – 2 x 33,20 = -57,24 kg
- Do ![]() \({\Delta _r}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
\({\Delta _r}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
Ví dụ 4: C ho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình.
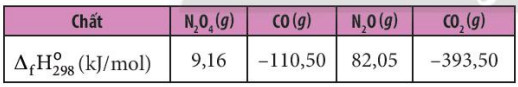
- Tính biến thiên enthalpy của phản ứng sau: N2O4 (g) + 3CO (g) → N2O (g) + 3CO2 (8)
- Theo công thức (2), ta có:
![]() \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}O) + 3.{\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0({N_2}{O_4}) - 3.{\Delta _f}H_{298}^0(CO)\)
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}O) + 3.{\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0({N_2}{O_4}) - 3.{\Delta _f}H_{298}^0(CO)\)
= 82,05 + 3 x (-393,50) - 9,16 - 3x (-110,50) = -776,11 kJ
- Do ![]() \({\Delta _f}H_{298}\)) < 0 nên phản ứng toả nhiệt.
\({\Delta _f}H_{298}\)) < 0 nên phản ứng toả nhiệt.
|
Tổng quát: Với |
|---|
B. Bài tập minh họa
Bài 1: Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp thì sẽ tạo ra hỗn hợp nổ
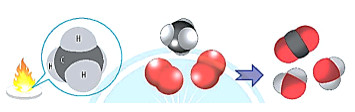
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Hướng dẫn giải
- Trong bất cứ phản ứng hóa học nào, nhiệt có thể hoặc là được thu vào hoặc là thoát ra môi trường xung quanh. Nhiệt độ trao đổi giữa phản ứng hóa học và môi trường xung quanh được gọi là entanpy của phản ứng, ký hiệu là H. Tuy nhiên, H không thể đo được một cách trực tiếp, thay vào đó, việc đo sự thay đổi nhiệt độ của phản ứng theo thời gian được sử dụng để tính sự biến thiên của entanpy theo thời gian (ký hiệu là ∆H). Biết ∆H của một phản ứng, ta có thể xác định được đó là phản ứng thu nhiệt (nhiệt của phản ứng lấy từ môi trường) hay tỏa nhiệt (nhiệt của phản ứng tỏa ra môi trường).
- Biến thiên enthalpy của phản ứng được tính toán dựa trên giá trị năng lượng liên kết hoặc dựa vào enthalpy tạo thành.
Bài 2: Tính biến thiên enthalpy của phản ứng phân hủy trinitroglycerin (C3H5O3(NO2)3), theo phương trình sau (biết nhiệt tạo thành của nitroglycerin là -370,15 kJ/mol):
4 C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Hướng dẫn giải
|
Chất |
C3H5O3(NO2)3(s) |
N2(g) |
CO2(g) |
H2O(g) |
O2(g) |
|
|
-370,15 |
0 |
-393,50 |
-241,82 |
0 |
![]() \({\Delta _r}H_{298}^o = 6.{\Delta _f}H_{298}^o(N2) + 12.{\Delta _f}H_{298}^o(CO2) + 10.{\Delta _f}H_{298}^o(H2O) + {\Delta _f}H_{298}^o(O2) - 4.{\Delta _f}H_{298}^o(C3H5O3(NO2)3\)
\({\Delta _r}H_{298}^o = 6.{\Delta _f}H_{298}^o(N2) + 12.{\Delta _f}H_{298}^o(CO2) + 10.{\Delta _f}H_{298}^o(H2O) + {\Delta _f}H_{298}^o(O2) - 4.{\Delta _f}H_{298}^o(C3H5O3(NO2)3\)
= 6.0 + 12.(-393,50) + 10.(-241,82) + 1.0 – 4.(-370,15) = -5659,60 kJ < 0
→ Phản ứng phân hủy trinitroglycerin tỏa ra lượng nhiệt rất lớn → Gây tính sát thương cao
→ Trinitroglycerin được ứng dụng làm thành phần của thuốc súng không khói.
C. Trắc nghiệm Hóa học 10 bài 14
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 14: Tính biến thiên Enthalpy của phản ứng hóa học CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









