Lý thuyết Hóa học 10 bài: Ôn tập chương 2
Lý thuyết Hóa lớp 10 bài: Ôn tập chương 2 được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Ôn tập chương 2
A. Lý thuyết Hóa học 10 bài Ôn tập chương 2
1. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
a. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì.
- Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp cùng một nhóm, trừ nhóm VIIIB.
b. Cấu tạo của bảng tuần hoàn
- Ô nguyên tố: Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hoá học trong ô đó.
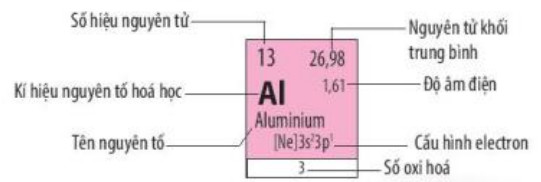
- Chu kì
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
- Nhóm: số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
c. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hoá học
- Dựa vào cấu hình electron: nguyên tố s, nguyên tố C, nguyên tố d và nguyên tố f.
- Dựa vào tính chất hoá học: nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm.
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm
a. Bán kính nguyên tử
- Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, từ trái sang phải, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần
+ Trong một nhóm, theo chiều từ trên xuống dưới bán kính nguyên tử có xu hướng tăng.
b. Độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, độ âm điện của nguyên từ các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
c. Tính kim loại, tính phi kim
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron.
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
d. Tính acid - base của oxide và hydroxide
Bảng 6.2. Tính acid – base của oxide và hydroxide tương ứng của các nguyên tố thuộc chu kì 2 và 3 (ứng với hoá trị cao nhất của các nguyên tố)
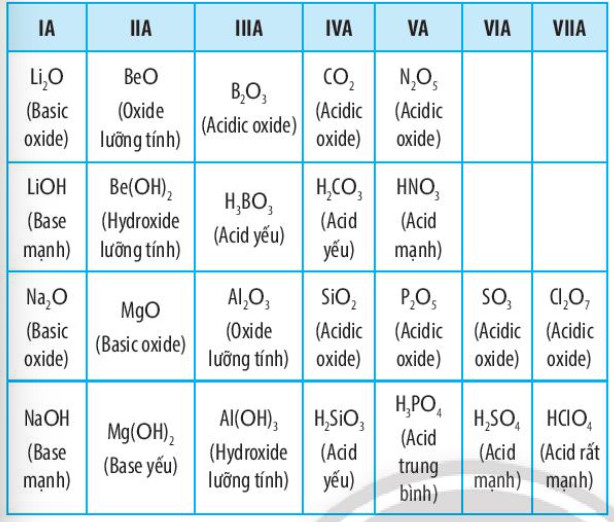
3. Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
a. Định luật tuần hoàn
Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
b. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Biết vị trí của một nguyên tố trong bảng tuần hoàn → Cấu tạo nguyên tử của nguyên tố đó và ngược lại → biết những tính chất hoá học cơ bản của nó.
B. Bài tập minh họa
Bài 1: Tổng số hạt proton, nơtron, electron của nguyên tử của một nguyên tố thuộc nhóm VIIA là 28.
a) Tính nguyên tử khối.
b) Viết cấu hình electron nguyên tử của nguyên tố đó.
Hướng dẫn giải
a) Tính nguyên tử khối.
Gọi tổng số hạt p là Z, tổng số hạt n là N, tổng số hạt e là E, ta có: Z + N + E = 28.
Vì Z = E, nên suy ra 2Z + N = 28 → 2Z = 28 - N
Ta có: 1 ≤ N/Z ≤ 1,5
→ Z ≤ N ≤ 1,5Z
Cộng 2Z vào từng vế ta được
2Z + Z ≤ N + 28 - N ≤ 1,5N + 2Z
3Z ≤ 28 ≤ 3,5Z → 8 ≤ Z ≤ 9,33.
Do Z là số nguyên dương nên Z = 9 → N = 10
b) Cấu hình electron: 1s 2 2s 2 2p 5 .
Bài 2: Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Hãy cho biết:
- Cấu hình electron của phosphorus.
- Số electron lớp ngoài cùng của nguyên tử phosphorus.
- Phosphorus là kim loại hay phi kim
- Công thức oxide cao nhất của phosphorus
- Công thức hợp chất khí của phosphorus với hydrogen
- Công thức hydroxide cao nhất của phosphorus
- Oxide và hydroxide cao nhất của phosphorus có tính acid hay base.
Hướng dẫn giải
Cấu hình electron của phosphorus: 1s22s22p63s23p3.
Số electron lớp ngoài cùng của nguyên tử phosphorus: 5.
Phosphorus là phi kim.
Công thức oxide cao nhất của phosphorus: P2O5.
Công thức hợp chất khí của phosphorus với hydrogen: PH3.
Công thức hydroxide cao nhất của phosphorus: H3PO4.
Oxide và hydroxide cao nhất của phosphorus có tính acid.
Bài 3: Một hợp chất có công thức XY2, trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid.
a. Viết cấu hình electron của X và Y
b. Xác định vị trí của X và Y trong bảng tuần hoàn và công thức phân tử hợp chất XY2.
Hướng dẫn giải
a) Gọi số hạt proton, neutron và electron của nguyên tử X là p, n, e và hạt proton, neutron và electron của nguyên tử Y là p’; n’; e’.
Theo bài ta ta có: p = n = e; p' = n' = e'
Một cách gần đúng ta có: MX = 2p; MY = 2p’.
Lại có trong XY2, X chiếm 50% về khối lượng nên:
MX : (2MY)= 50 : 50 = 1 hay 2p ; 4p' = 1⇒ p = 2p′ (1)
Tổng số proton trong phân tử XY2 là 32 nên: p + 2p’ = 32 (2)
Từ (1) và (2) giải hệ phương trình được: p = 16 và p’ = 8.
p = 16 nên ZX = 16, X có cấu hình electron: 1s22s22p63s23p4
p’ = 8 nên ZY = 8, Y có cấu hình electron: 1s22s22p4
b)
X ở ô thứ 16 (do Z = 16), chu kì 3 (do có 3 lớp electron), nhóm VIA (do nguyên tố p, có 6 electron lớp ngoài cùng); X là sulfur (S).
Y ở ô thứ 8 (do Z = 8), chu kì 2 (do có 2 lớp electron), nhóm VIA (do nguyên tố p, có 6 electron lớp ngoài cùng); Y là oxygen (O).
Công thức phân tử hợp chất XY2 là SO2.
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài: Ôn tập chương 2 CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.










