Lý thuyết Hóa học 10 bài: Ôn tập chương 3
Lý thuyết Hóa lớp 10 bài: Ôn tập chương 3 được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Ôn tập chương 3
A. Lý thuyết Hóa học 10 bài Ôn tập chương 3
1. Quy tắc Octet
Quy tắc Octet (bát tử): Trong quá trình hình thành liên kết hoá học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
2. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Trong điều kiện thưởng, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
3. Liên kết cộng hóa trị
a. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung
+ Liên kết cộng hóa trị không phân cực là liên kết cộng hoá trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
+ Liên kết cộng hóa trị phân cực là liên kết cộng hoá trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
- Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
b. Phân biệt các loại liên kết dựa theo độ âm điện
- Dựa trên hiệu độ âm điện xác định loại liên kết hóa học:
|
Hiệu độ âm điện (∆x) |
Loại liên kết |
|
0 ≤ ∆x < 0,4 |
Cộng hóa trị không cực |
|
0,4 ≤ ∆x < 1,7 |
Cộng hóa trị có cực |
|
≥ 1,7 |
Ion |
c. Liên kết ![]() \(\sigma\),
\(\sigma\),![]() \(\pi\) và năng lượng liên kết
\(\pi\) và năng lượng liên kết
- Liên kết ![]() \(\sigma\) là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
\(\sigma\) là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
- Liên kết ![]() \(\pi\) là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ năm hai bên đường nội tâm hai nguyên tử.
\(\pi\) là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ năm hai bên đường nội tâm hai nguyên tử.
- Năng lượng của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí.
- Giá trị năng lượng của một liên kết hoá học là thước đo độ bền liên kết.
4. Liên kết hydrogen và tương tác van der waals
a. Liên kết hydrogen
- Liên kết hydrogen là một loại liên kết yếu, được hình thánh giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cập electron hóa trị chưa tham gia liên kết.
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
b. Tương tác Van der Waals
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. Bài tập minh họa
Bài 1: Cho dãy các chất kèm theo nhiệt độ sôi (°C) sau:
HF (19,5; HCI (- 85), HBr (- 66); HI (- 35).
a) Nêu xu hướng biến đổi nhiệt độ sôi trong dãy chất trên.
b) Đề xuất lí do nhiệt độ sôi của HF không theo xu hướng này.
Hướng dẫn giải
a) Sự tăng nhiệt độ sôi từ HCI đến HI do khối lượng phân tử tăng.
b) HF có liên kết hydrogen làm cho các phân tử liên kết với nhau chặt chẽ hơn nên nhiệt độ sôi cao hơn.
Bài 2: Cho biết tổng số electron trong anion AB32- là 42. Trong các hạt nhân A cũng như B có số proton bằng số neutron.
a) Tính số khối của A, B.
b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet.
Hướng dẫn giải
a) - Gọi số hạt proton, electron và neutron trong nguyên tử A lần lượt là p1, e1, n1
- Có số hạt proton, electron và neutron trong B lần lượt là p2, e2, n2
- Có tổng số electron trong anion AB32- là 42
=> p1 + 3p2 + 2 = 42 => ![]() \(3{p_2} = 40 - {p_1} " {p_2} < \frac{{40}}{3} = 13,333\)
\(3{p_2} = 40 - {p_1} " {p_2} < \frac{{40}}{3} = 13,333\)
- Do trong các hạt nhân A cũng như B có số proton bằng số neutron
=> p2 = 8 => p1 = 16 => A là nguyên tố sulfur (S) và B là nguyên tố oxygen (O)
- Số khối của S = 16 + 16 = 32
- Số khối của O = 8 + 8 = 16
b)
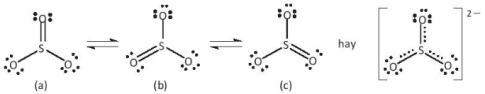
Bài 3: Cho các phân tử sau: H 2 , CHCl 3 , CH 4 , N 2 . Hãy cho biết phân tử nào chứa liên kết cộng hoá trị phân cực?
Hướng dẫn giải
Dựa vào hiệu độ âm điện:
|
Hiệu độ âm điện |
Loại liên kết |
|
|
Cộng hóa trị không phân cực |
|
|
Cộng hóa trị phân cực |
|
|
Ion |
|
|
Phân tử CHCl3 |
Phân tử CH4 |
|
Hiệu độ âm điện |
- Liên kết C-H có
-> Liên kết cộng hóa trị không phân cực - Liên kết C-Cl có
-> Liên kết cộng hóa trị phân cực |
- Liên kết C-H có
-> Liên kết cộng hóa trị không phân cực |
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài: Ôn tập chương 3 CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









