Lý thuyết Hóa học 10 bài 18 CTST
Chúng tôi xin giới thiệu bài Lý thuyết Hóa lớp 10 bài 18: Hydrogen Halide và một số phản ứng của ion Halide được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
A. Lý thuyết Hóa học 10 bài 18
1. Tính chất vật lí của Hydrogen Halide
* Giải thích xu hướng biến đổi tính chất vật lí của Hydrogen halide
- Hydrogen halide là hợp chất của hydrogen với halogen, công thức tổng quát là HX, với X là halogen. Hậu tố “ide” trong hydrogen halide được thay thế từ hậu tố “ine” của tên halogen.
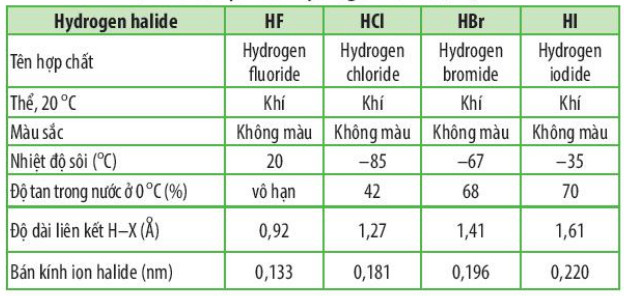
Bảng 18.1. Bảng mô tả đặc điểm, tính chất vật lí của hydrogen halide (HX)
|
- Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sối; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng. - Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại. |
|---|
2. Hydrohalic Acid
* Tìm hiểu tính acid của các Hydrohalic Acid
- Các hydrogen halide tan trong nước, tạo thành hydrohalic acid tương ứng. Hydrofluoric acid (HF) là acid yếu, nhưng có tính chất đặc biệt là ăn mòn thủy tinh, phương trình hóa học của phản ứng: SiO2 + 4HF → SiF4 + 2H2O
- Các dung dịch HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hoá học chung của acid như làm quỳ tím chuyển sang màu đỏ, tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hoá học, tác dụng với basic oxide, base và một số muối.
| Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid. |
|---|
- Trong dịch vị dạ dày của người có hydrochloric acid với nồng độ trong khoảng 10-4 - 10-3 mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ.
3. Tính khử của các ion Halide
* Tìm hiểu tính chất của các ion Halide
- Trong ion halide, các halogen có số oxi hóa thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hoá - khử.
Khi đun nóng các muối khan halide với chất oxi hóa mạnh, như dung dịch H,SO, đặc, ion chloride không khử được H2SO4 nên chỉ xảy ra phản ứng trao đổi (Hình 18.3a).
KCl + H2SO4 (đặc) → KHSO4 + HCl
- Ion bromide khử H2SO4 đặc thành SO2 và Br- bị oxi hoá thành Br2 sản phẩm có màu vàng đậm (Hình 18.3b).
![]() \(2K\mathop {Br}\limits^{ - 1} \,\, + \,\,2{H_2}\mathop S\limits^{ + 6} {O_4}(dac) \to \mathop {B{r_2}}\limits^0 + \mathop S\limits^{ + 4} {O_2} + {K_2}S{O_4} + 2{H_2}O\)
\(2K\mathop {Br}\limits^{ - 1} \,\, + \,\,2{H_2}\mathop S\limits^{ + 6} {O_4}(dac) \to \mathop {B{r_2}}\limits^0 + \mathop S\limits^{ + 4} {O_2} + {K_2}S{O_4} + 2{H_2}O\)
- Ion iodide có thể khử H2SO4 đặc thành H2S, S, SO2 tùy vào điều kiện phản ứng và I- bị oxi hóa thành I2 có màu đen tím (Hình 18.3c)

Hình 18.3. Các muối KCl (a), KBr (b), KI (c) phản ứng với dung dịch H2SO4 đặc
| Tính khử của các ion halide tăng theo chiều F- < Cl- < Br- < I- |
|---|
4. Nhận biết ion Halide trong dung dịch
* Thực hành thí nghiệm nhận biết ion halide trong dung dịch
- Hoá chất: các dung dịch NaF, NaCl, NaBr, Nal và AgNO3 có cùng nồng độ 0,1 M.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt, giá để ống nghiệm. Tiến hành
- Tiến hành:
+ Bước 1: Lấy lần lượt khoảng 2 mL mỗi dung dịch NaF, NaCl, NaBr và NaI cho vào 4 ống nghiệm, được đánh số thứ tự từ 1 đến 4.
+ Bước 2: Thêm tiếp vào mỗi ống nghiệm vài giọt dung dịch AgNO3. Phương trình hóa học của các phản ứng:
NaCl + AgNO3 → AgCl + NaNO3
NaBr + AgNO3 → AgBr + + NaNO3
Nal + AgNO3 → AgI + NaNO3
- Dung dịch NaF không phản ứng với dung dịch AgNO3
| Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng. |
|---|
5. Ứng dụng của các Hydrogen Halide
* Tìm hiểu các ứng dụng của hydrogen halide
- Hydrogen fluoride: Dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, ...
- Hydrogen chloride: Dùng để loại bỏ gỉ thép; sản xuất chất tẩy rửa nhà vệ sinh, các hợp chất vô cơ và hữu cơ phục vụ đời sống, sản xuất, ...
- Hydrogen bromide: Làm chất xúc tác cho các phản ứng hữu cơ, tổng hợp chất chống cháy chữa nguyên tố bromine như tetrabromobisphenol A, điều chế nhựa epoxy, sản xuất các vi mạch điện tử, ...
- Hydrogen iodide: Dùng làm chất khử phổ biến trong các phản ứng hoá học; sản xuất iodine và alkyl iodide, ...
| Hydrogen halide có nhiều ứng dụng trong đời sống và sản xuất. |
|---|
B. Bài tập minh họa
Bài 1: Thủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản. Trước đây, muốn khắc các hoa văn, cần phủ lên bề mặt thủy tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thủy tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thủy tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí. Quá trình ăn mòn thủy tinh xảy ra thế nào? Các ion halide có tính chất gì?
Hướng dẫn giải
- Quá trình ăn mòn thủy tinh: CaF2 + 2H2SO4 → CaSO4 + 2HF↑
+ Thủy tinh có thành phần chính là SiO2
SiO2 + 4HF → SiF4↑ + 2H2O
- Các ion halide có tính khử
Bài 2: Điện phân nóng chảy một muối 11,7g halogenua NaX người ta thu được 2,24 lít khí (đktc).
a) Xác định nguyên tố X ?
b) Tính thế tích khí HX thu được khi cho X tác dụng với 4,48 lít H2 ở đktc ?
c) Tính tỷ lệ % các khí sau phản ứng ?
Hướng dẫn giải
PTHH: 2NaX → 2Na + X2
a, nX2 = 0,1 mol ⇒ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ⇒ X = 35,5 (Cl)
b, X2 + H2 → 2HX
nH2 = 0,2 mol ⇒ nHX = 2. nX2= 0,2 mol (H2 dư)
⇒ VHX = 0,2.22,4 = 4,48 l
c, Sau phản ứng có 0,2 mol khí HCl và 0,1 mol H2 dư
%HCl= 0,2/(0,2 + 0,1)= 66,67%
⇒ %H2 = 33,33%
Bài 3: Để hoà tan hoàn toàn 8,1g một kim loại X thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đktc).
a) Xác định X
b) Tính giá trị V.
c) Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn giải
a, PTHH: 2X + 6HCl → 2XCl3 + 3H2
nHCl = 0,45 .2 =0,9 mol ⇒ nX = 0,9/3= 0,3 mol
MX = 8,1 /0,3 = 27 (Al)
b, nH2 = 1/2nHCl =0,45 mol
VH2 = 0,45 .22,4 = 10,08 l
c, Dung dịch A là AlCl3
nAlCl3 = nX = 0,3 mol
CM = n/V = 0,3/0,45 = 0,67M
C. Trắc nghiệm Hóa học 10 bài 18
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 18: Hydrogen Halide và một số phản ứng của ion Halide CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.










