Lý thuyết Hóa học 10 bài: Ôn tập chương 7
Chúng tôi xin giới thiệu bài Lý thuyết Hóa lớp 10 bài: Ôn tập chương 7 được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách chân trời sáng tạo. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
A. Lý thuyết Hóa học 10 bài Ôn tập chương 7
1. Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Vị trí trong bảng tuần hoàn
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hoá học: fluorine (F), chlorine (CI), bromine (Br), iodine (I), astatine (At) và tennessine (Ts).
- Các nguyên tố halogen thuộc nhóm VIIA. Chúng đứng gần cuối chu kì, ngay trước các nguyên tố khí hiếm.
Cấu hình electron, đặc điểm cấu tạo phân tử halogen
- Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5)
- Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
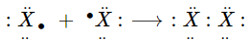
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
Tính chất vật lý
- Từ fluorine den iodine:
+ Trạng thái tập hợp của đơn chất ở 20°C thay đổi: fluorine và chlorine thể khí, bromine ở thể lỏng, iodine ở thể rắn.
+ Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
+ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
Tính chất hóa học
- Tính chất hoá học đặc trưng của halogen là tính oxi hoá mạnh, tính oxi hoá giảm dần từ fluorine den iodine.
+ Tác dụng với kim loại
+ Tác dụng với hydrogen
+ Tác dụng với dung dịch muối halide
+ Tác dụng với dung dịch kiềm
2. Hydrogen Halide và một số phản ứng của ion Halide
Tính chất vật lí của Hydrogen Halide
- Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng.
- Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
Hydrohalic Acid
Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
Tính khử của các ion Halide
Tính khử của các ion halide tăng theo chiều F- < Cl- < Br- < I-
Nhận biết ion Halide trong dung dịch
Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.
B. Bài tập minh họa
Bài 1: Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối X của potassium (K). Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng. Nhỏ vài giọt nước Br2 vào ống thứ hai, lắc đều rồi thêm hồ tinh bột, thấy có màu xanh tím. Xác định công thức hoá học của X và viết phương trình hóa học của các phản ứng.
Hướng dẫn giải
- Sau khi thêm hồ tinh bột thấy có màu xanh tím → chứng tỏ sau phản ứng có sinh ra I2 → Muối là KI
- Các phương trình phản ứng:
KI + AgNO3 → KNO3 + AgI (vàng)
2KI + Br2 → 2KBr + I2
Bài 2: Cho từ từ đến hết 10 g dung dịch X gồm NaF 0,84% và NaCl 1,17%, vào dung dịch AgNO3 dư, thu được m g kết tủa. Tính giá trị của m.
Hướng dẫn giải
![]() \({n_{NaCl}} = \frac{{10.1,17}}{{100.58,5}} = 0,002\) mol
\({n_{NaCl}} = \frac{{10.1,17}}{{100.58,5}} = 0,002\) mol
- Xét phản ứng: NaCl + AgNO3 → AgCl + NaNO3
0,002 → 0,002 (mol)
→ mkếttủa = 0,002.143,5 = 0,287 gam (AgF là muối tan)
Bài 3: Có hai ống nghiệm, mỗi ống chứa 2 mL dung dịch muối của sodium Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng nhạt. Nhỏ vài giọt nước Cl2 vào ống thứ hai, lắc nhẹ, thêm 1 mL benzene và lắc đều, thấy benzene từ không màu chuyển sang màu da cam. Xác định công thức của muối sodium và viết phương trình hoá học của các phản ứng xảy ra.
Hướng dẫn giải
- Cho vài giọt dung dịch AgNO3 vào ống thứ nhất, thu được kết tủa màu vàng nhạt
→ Muối của sodium là NaBr
NaBr + AgNO3 → NaNO3 + AgBr (kết tủa vàng nhạt)
- Benzene từ không màu chuyển sang màu da cam là do khi Br2 tan trong benzene xuất hiện màu da cam
2NaBr + Cl2 → 2NaCl + Br2
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài: Ôn tập chương 7 CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









