Lý thuyết Hóa học 10 bài 8 CTST
VnDoc xin giới thiệu bài Lý thuyết Hóa học lớp 10 bài 8: Quy tắc Octet được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Quy tắc Octet
A. Lý thuyết Hóa học 10 bài 8
1. Liên kết hóa học
- Tìm hiểu sự hình thành liên kết hóa học
- Trong hóa học, liên kết hóa học là lực, giữ cho các nguyên tử cùng nhau trong các phân tử hay các tinh thể.
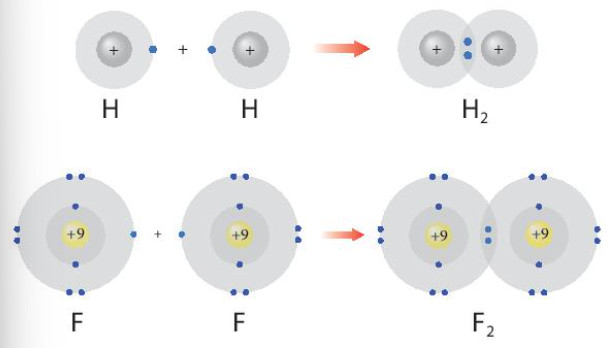
Hình 8.1. Sự hình thành các phân tử hydrogen và flurione
- Phần tử được tạo nên từ các nguyên tử bằng các liên kết hoá học.
2. Quy tắc Octet
- Tìm hiểu cách vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
+ Để đạt cấu hình electron bền vững của các khí hiếm gần nhất, nguyên tử của các nguyên tố có xu hướng nhường hoặc nhận thêm, hoặc góp chung các electron hoá trị với các nguyên tử khác khi tham gia liên kết hóa học.
+ Ví dụ, liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử nitrogen đã góp chung 3 electron hoá trị, tạo nên 3 cặp electron chung như Hình 8.2.
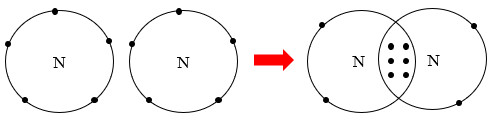
Hình 8.2. Sự hình thành liên kết trong phân tử nitrogen
- Tìm hiểu cách vận dụng quy tắc Octet trong sự hình thành ion dương, ion âm
+ Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron này, nguyên tử sodium sẽ đạt được cấu hình electron bền vững sau:
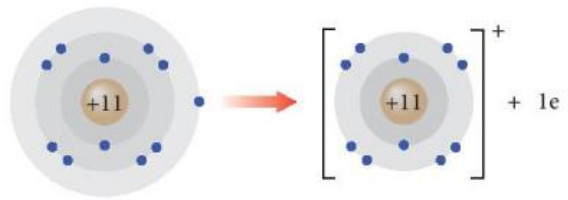
Nguyên tử sodium (Na) lon sodium (Na+)
Hình 8.3. Sự hình thành ion Na+
+ Phần tử thu được mang điện tích dương, gọi là ion sodium, kí hiệu Na+.
+ Tương tự, nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron, nguyên tử fluorine sẽ đạt được cấu hình electron bền vững sau:
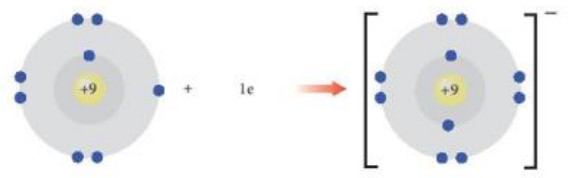
Nguyên tử fluorine (F) Ion fluoride (F-)
Hình 8.4. Sự hình thành ion F -
+ Phần tử thu được mang điện tích âm, gọi là ion fluoride, kí hiệu F-.
+ Không phải trong mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc Octet.
+ Người ta nhận thấy một số phân tử có thể không tuân theo quy tắc Octet. Ví dụ: NO, BH 3 , SF 6 ...
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một quy tắc khác, tương ứng với quy tắc Octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.
| Quy tắc Octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium). |
|---|
B. Bài tập minh họa
Bài 1: Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc Octet là gì?
Hướng dẫn giải
Quy tắc Octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
Bài 2: Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Hướng dẫn giải
- Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine có 7 electron lớp ngoài cùng
+ Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
→ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
→ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung
Bài 3: Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
Hướng dẫn giải
Khi nguyên tử F nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ne.
C. Trắc nghiệm Hóa học 10 bài 8
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 8: Quy tắc Octet CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









