Lý thuyết Hóa học 10 bài 3 CTST
VnDoc xin trân trọng giới thiệu bài Lý thuyết Hóa lớp 10 bài 3: Nguyên tố hóa học được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Nguyên tố hóa học
A. Lý thuyết Hóa 10 bài 3
1. Hạt nhân nguyên tử
a. Tìm hiểu về điện tích hạt nhân
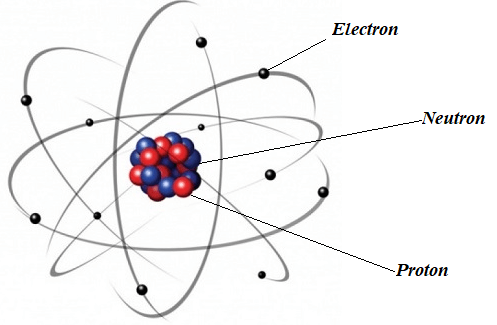
Hình 3.1. Mô hình nguyên tử nitrogen theo Rutherford
|
- Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E). - Điện tích hạt nhân = +Z. |
|---|
b. Tìm hiểu về số khối của nguyên tử
Bảng 3.1. Số lượng các hạt cơ bản và số khối của nguyên tử một số nguyên tố
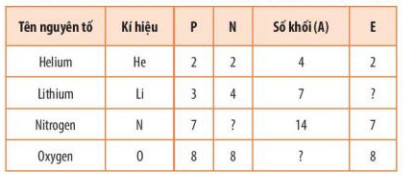
| Số khối (A) = số proton (P) + số neutron (N) |
|---|
2. Nguyên tố Hóa học
a. Tìm hiểu về số hiệu nguyên tử
- Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó.
- Số hiệu nguyên tử (kí hiệu là Z) cho biết:
+ Số proton trong hạt nhân nguyên tử.
+ Số electron trong nguyên tử.
|
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử (Z) của nguyên tố đó. - Mỗi nguyên tố hoá học có một số hiệu nguyên tử. |
|---|
b. Tìm hiểu khái niệm nguyên tố hoá học
Protium, deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
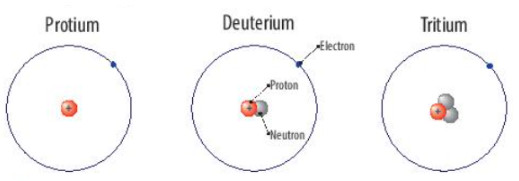
Hình 3.2. Các loại nguyên tử của nguyên tố hydrogen
| Nguyên tố hoá học là tập hợp những nguyên tử có cùng diện tích hạt nhân. |
|---|
c. Tìm hiểu kí hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử (còn được gọi là số hiệu nguyên tử) của một nguyên tố hoá học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
- Để kí hiệu nguyên tử, người ta thường ghi các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố với số khối A ở phía trên, số hiệu nguyên tử Z ở phía dưới.
|
Kí hiệu nguyên tử được sử dụng để biểu thị nguyên tử của một nguyên tố hoá học.
- A là số khối - Z là số hiệu nguyên tử - X là kí hiệu nguyên tố hóa học |
|---|
3. Đồng vị
- Tìm hiểu khái niệm đồng vị
+ Các nguyên tử của cùng một nguyên tố hoá học có thể có số khối khác nhau. Sở dĩ như vậy vì hạt nhân của các nguyên tử đó có cùng số proton, nhưng có thể khác số neutron. Những nguyên tử này được gọi là đồng vị của một nguyên tố hoá học.
+ Trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị. Một nguyên tố hoá học dù dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi. Ví dụ, các quả chuối đều chứa nguyên tố potassium (K) trong thành phần dinh dưỡng của chúng. Chúng có thể khác nhau về kích thước, hình dáng, mùi vị cũng như được thu hoạch ở những vị trí địa lí khác nhau nhưng đều chứa 93,26% số nguyên tử ![]() \(_{19}^{39}K\); 6,73% số nguyên tử
\(_{19}^{39}K\); 6,73% số nguyên tử ![]() \(_{19}^{41}K\) và 0,01% số nguyên tử
\(_{19}^{41}K\) và 0,01% số nguyên tử ![]() \(_{19}^{40}K\) trong tổng số nguyên tử potassium có trong chúng.
\(_{19}^{40}K\) trong tổng số nguyên tử potassium có trong chúng.
+ Ngoài những đồng vị bền, các nguyên tố hoá học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học, ...
| Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N). Do đó, số khối (A) của chúng khác nhau. |
|---|
4. Nguyên tử khối và nguyên tử khối trung bình
a. Tìm hiểu nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử. Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron và electron trong nguyên tử đó. Proton và neutron đều có khối lượng gần bằng 1 amu, electron có khối lượng nhỏ hơn rất nhiều (khoảng 0,00055 amu). Do đó, có thể coi nguyên tử khối có giá trị bằng số khối.
| Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu). |
|---|
b. Xác định nguyên tử khối trung bình
- Mỗi nguyên tố thường có nhiều đồng vị, do đó trong thực tế, người ta thường sử dụng giá trị nguyên tử khối trung bình. Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường sử dụng phương pháp phổ khối lượng (Mass Spectrometry-MS) để xác định phần trăm số nguyên tử các đồng vị trong tự nhiên của các nguyên tố. Đây cũng là một phương pháp quan trọng trong việc phân tích thành phần và cấu trúc các chất.
- Trong tự nhiên, Chlorine có hai đồng vị là ![]() \(_{17}^{35}Cl\) và
\(_{17}^{35}Cl\) và ![]() \(_{17}^{37}Cl\) có tỉ lệ phần trăm số nguyên tử tương ứng là 75,76% và 24,24%.
\(_{17}^{37}Cl\) có tỉ lệ phần trăm số nguyên tử tương ứng là 75,76% và 24,24%.
- Cách xác định nguyên tử khối trung bình của Chlorine: ![]() \(\overline {{A_{Cl}}} = \frac{{({A_{35}}_{Cl}.{\% ^{35}}Cl) + ({A_{37Cl}}.{\% ^{37}}Cl)}}{{100}} = \frac{{(35.75,76) + (37x24,24)}}{{100}}\)
\(\overline {{A_{Cl}}} = \frac{{({A_{35}}_{Cl}.{\% ^{35}}Cl) + ({A_{37Cl}}.{\% ^{37}}Cl)}}{{100}} = \frac{{(35.75,76) + (37x24,24)}}{{100}}\)
|
Công thức tính nguyên tử khối trung bình của nguyên tố X:
Ai là nguyên tử khối đồng vị thứ i. ai là tỉ lệ % số nguyên tử đồng vị thứ i. |
|---|
B. Bài tập minh họa
Bài 1: Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên, chúng đều được tạo thành từ cùng một nguyên tố hóa học là nguyên tố carbon (C). Nguyên tố hoá học là gì? Một nguyên tử của nguyên tố hoá học có những đặc trưng cơ bản nào?
Hướng dẫn giải
- Nguyên tố hóa học là tập hợp tất cả các nguyên tử có cùng điện tích hạt nhân
- Một nguyên tử của nguyên tố hóa học có những đặc trưng: số khối A và điện tích hạt nhân
Bài 2: Nguyên tử sodium có 11 proton. Cho biết số đơn vị điện tích hạt nhân và số electron của nguyên tử này
Hướng dẫn giải
- Nguyên tử sodium có 11 proton
→ Số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11
Vậy số đơn vị điện tích hạt nhân và số electron của nguyên tử sodium đều bằng 11
C. Trắc nghiệm Hóa 10 bài 3
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 3: Nguyên tố hóa học CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.