Lý thuyết Hóa học 10 bài 2 CTST
Lý thuyết Hóa lớp 10 bài 2: Thành phần của nguyên tử được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Thành phần của nguyên tử
A. Lý thuyết Hóa học 10 bài 2
1. Thành phần cấu tạo nguyên tử
- Trình bày thành phần cấu tạo nguyên tử
+ Từ thời cổ Hy Lạp, nhà triết học Democritous (Đề-mô-crít, 460 - 370 trước Công Nguyên) cho rằng mọi vật chất được tạo thành từ các phần tử rất nhỏ được gọi là “atoos", nghĩa là không thể phá huỷ và không thể chia nhỏ hơn được nữa. Đến giữa thế kỉ XIX, các nhà khoa học cho rằng: các chất đều được cấu tạo nên từ những hạt rất nhỏ, không thể phân chia được nữa, gọi là nguyên tử. Vào cuối thế kỉ XIX, đầu thế kỉ XX, bằng những nghiên cứu thực nghiệm, các nhà khoa học đã chứng minh sự tồn tại của nguyên tử và nguyên tử có cấu tạo phức tạp
2. Sự tìm ra electron
- Tìm hiểu thí nghiệm khám phá tia âm cực của Thomson
+ Năm 1897, nhà vật lí người Anh J. J. Thomson (Tôm-xơn) thực hiện thí nghiệm phóng điện trong một ống thuỷ tinh gần như chân không gọi là ống tia âm cực). Ông quan sát thấy màn huỳnh quang trong ống phát sáng do những tia phát ra từ cực âm (gọi là tia âm cực) và những tia này bị hút về cực dương của trường điện (Hình 2.2), chứng tỏ chúng tích điện âm. Đó chính là chùm các hạt electron.
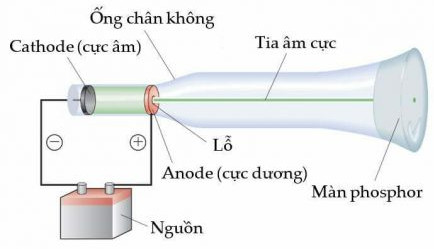
Hình 2.2. Thí nghiệm của Thomson
|
- Trong nguyên tử tồn tại một loại hạt có khối lượng và mang diện tích âm, được gọi là electron (kí hiệu là e). - Hạt electron có: + Điện tích: qe = -1,602.10-19 C(coulomb). + Khối lượng m = 9,11.10-28g. - Người ta chưa phát hiện được điện tích nào nhỏ hơn 1,602.10-19 C nên nó được dùng làm điện tích đơn vị, điện tích của electron được quy ước là -1. |
|---|
3. Sự khám phá hạt nhân nguyên tử
- Tìm hiểu thí nghiệm của Rutherford
+ Năm 1911, nhà vật lí người New Zealand là E. Rutherford (Rơ-do-pho) đã tiến hành bắn phá một chùm hạt alpha (kí hiệu là \(\alpha \), hạt nhân của nguyên tử helium, mang điện tích +2, có khối lượng gấp khoảng 7500 lần khối lượng electron) lên một lá vàng siêu mỏng (Hình 2.3) và quan sát đường đi của chúng sau khi bắn phá bằng màn huỳnh quang (zinc sulfile, ZnS).
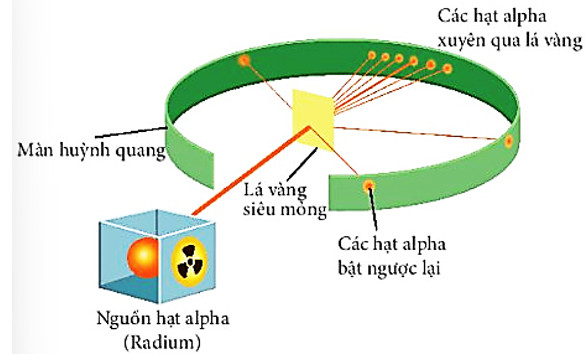
Hình 2.3. Thí nghiệm khám phá hạt nhân nguyên tử của Rutherford
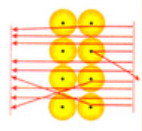
Hình 2.4. Kết quả thí nghiệm khám phá hạt nhân nguyên tử của Rutherford
|
- Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân. - Nguyên tử trung hòa về điện: số đơn vị điện tích đương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử. |
|---|
4. Cấu tạo hạt nhân nguyên tử
- Tìm hiểu sự xuất hiện của proton và neutron
+ Vào năm 1918, khi bắn phá hạt nhân nguyên tử nitrogen bằng các hạt ![]() \(\alpha\) (thực hiện trong máy gia tốc hạt), Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử Oxygen và một loại hạt mang một đơn vị diện tích dương (e hay +1), đó là proton (kí hiệu là p).
\(\alpha\) (thực hiện trong máy gia tốc hạt), Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử Oxygen và một loại hạt mang một đơn vị diện tích dương (e hay +1), đó là proton (kí hiệu là p).
+ Năm 1932, khi dùng các hạt ![]() \(\alpha\) để bắn phá hạt nhân nguyên tử beryllium J, Chadwick (Chit-uých) nhận thấy sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện. Ông gọi chung là neutron (kí hiệu là n).
\(\alpha\) để bắn phá hạt nhân nguyên tử beryllium J, Chadwick (Chit-uých) nhận thấy sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện. Ông gọi chung là neutron (kí hiệu là n).
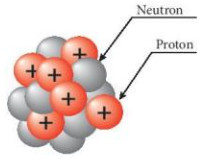
Hình 2.5. Thành phần hạt nhân nguyên tử
| Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron. Proton mang diện tích dương (+1) và neutron không mang điện. Proton và neutron Cỏ khối lượng gần bằng nhau. |
|---|
5. Kích thước và khối lượng nguyên tử
a. So sánh kích thước nguyên tử và hạt nhân nguyên tử
- Nếu hình dung hạt nhân là một khối cấu có kích thước như viên bi thì nguyên tử sẽ là một khối cầu có kích thước bằng một sân bóng đá.
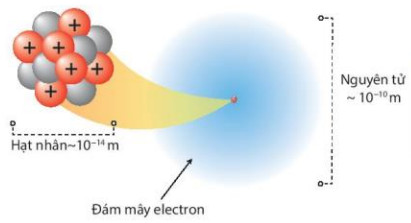
Hình 2.6. Đường kính nguyên tử, hạt nhân trong nguyên tử carbon
- Đơn vị nanovet (nm) hay angstrom ![]() \(\mathop A\limits^0\) thường được sử dụng để biểu thị kích thước nguyên tử.
\(\mathop A\limits^0\) thường được sử dụng để biểu thị kích thước nguyên tử.
1 nm = 10-9m; 1![]() \(\mathop A\limits^0\) = 10-19 m; 1 nm = 10
\(\mathop A\limits^0\) = 10-19 m; 1 nm = 10![]() \(\mathop A\limits^0\))
\(\mathop A\limits^0\))
| Nếu xem nguyên tử như một quả cầu, trong đó các electron chuyển động rất nhanh xung quanh hạt nhân thì nguyên tử đó có đường kính khoảng 10-14m và đường kính hạt nhân khoảng 10 m. Như vậy, đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần. |
|---|
b. Tìm hiểu khối lượng của nguyên tử
Bảng 2.1. Một số tính chất của các loại hạt cơ bản trong nguyên tử
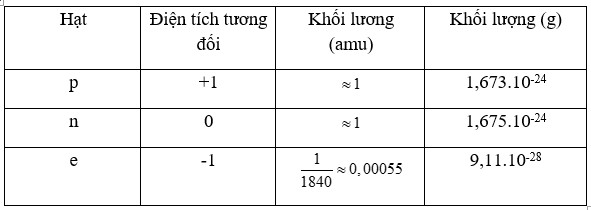
- Để biểu thị khối lượng của nguyên tử, các hạt proton, neutron và electron, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu.
1 amu bằng 1/12 khối lượng nguyên tử của carbon -12.
1 amu = 1,66.10-24 g
| Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron không đáng kể so với khối lượng của proton và neutron. |
|---|
B. Bài tập minh họa
Bài 1: Từ rất lâu, các nhà khoa học đã nghiên cứu các mô hình nguyên tử và cập nhật chúng thông qua việc thu thập những dữ liệu thực nghiệm. Nguyên tử gồm những hạt cơ bản nào? Cơ sở nào để phát hiện ra các hạt cơ bản đó và chúng có tính chất gì?
Hướng dẫn giải
- Nguyên tử gồm 3 hạt cơ bản:
+ Hạt electron: mang điện tích âm
+ Hạt proton: mang điện tích dương
+ Hạt neutron: không mang điện
- Cơ sở tìm ra:
+ Electron: phóng điện trong ống thủy tinh chân không (ống tia âm cực)
+ Proton và neutron: tiến hành bắn phá 1 chùm hạt alpha lên 1 lá vàng siêu mỏng.
Bài 2: Nguyên tử natri (sodium) có điện tích hạt nhân là +11. Cho biết số proton và số electron trong nguyên tử này?
Hướng dẫn giải
- Nguyên tử natri có điện tích hạt nhân là +11
→ Số đơn vị điện tích hạt nhân = 11
- Mà số đơn vị điện tích hạt nhân = số proton = số electron trong nguyên tử
→ Nguyên tử natri có 11 proton và 11 electron
C. Trắc nghiệm Hóa học 10 bài 2
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 2: Thành phần của nguyên tử CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.








