Lý thuyết Hóa học 10 bài 16 CTST
Lý thuyết Hóa lớp 10 bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
A. Lý thuyết Hóa học 10 bài 16
1. Ảnh hưởng của nồng độ
* Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng
Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Hoá chất: dung dịch sodium thiosulfate (Na2S2O3) 0,15 M; sulfuric acid (H2SO4) 0,10 M; nước cất.
- Dụng cụ: cốc thủy tinh 100 mL (được đánh dấu thập ở mặt ngoài đáy cốc), ống đong 50 mL.
- Tiến hành:
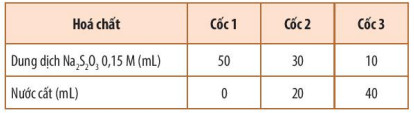
+ Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M để được các dung dịch có nồng độ khác nhau theo Bảng 16.1.
Bảng 16.1. Cách pha loãng dung dịch Na2S2O3
+ Bước 2: Rót đồng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hóa học của phản ứng: Na2S2O3 (aq) + H2SO4 (aq) → Na2SO4 (aq) +S (s) + SO2 (g) + H2O (l)

Hình 16.1. Thí nghiệm ảnh hưởng của nồng độ đến tốc độ phản ứng
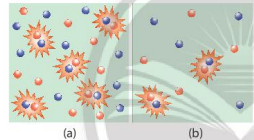
Hình 16.2. Hình minh hoạ chất phản ứng có nồng độ lớn (a) và nồng độ bé (b)
- Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
| Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng. |
|---|
2. Ảnh hưởng của nhiệt độ
- Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Ví dụ 1: Có 2 cốc thủy tinh, mỗi cốc đựng cùng một lượng hỗn hợp dụng dịch oxalic acid (H2C2O4) và dung dịch H2SO4 loãng, tỉ lệ 2:1 về thể tích, cốc (1) được đun nóng, thêm đồng thời cùng một lượng dung dịch KMnO4 vào mỗi cốc (Hình 16.3a), nhận thấy màu của hỗn hợp phản ứng nhạt dần theo thời gian phản ứng (Hình 16.3b).
- Phương trình hoá học của phản ứng: 2KMnO4 (aq) +5H2C2O4 (aq) + 3H2SO4 (aq) →MnSO4 (aq) + K2SO4 (aq) +10CO2(g) +8H2O (1)

Hình 16.3. Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ, các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nến tốc độ phản ứng tăng.
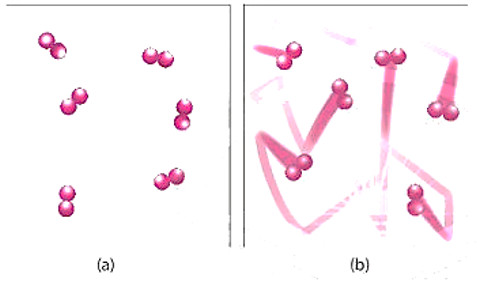
Hình 16.4. Hình minh hoạ chuyển động của chất phản ứng khi chưa đun nóng (a) và được đun nóng (b)
- Kết quả từ các thực nghiệm cho biết, khi nhiệt độ tăng lên 10°C, tốc độ của phần lớn các phản ứng tăng từ 2 đến 4 lần. Số lần tăng này được gọi là hệ số nhiệt độ Van't Hoff (Van-hop), kí hiệu là ![]() \(\gamma\).
\(\gamma\).
- Trong Ví dụ 1, nếu nhiệt độ ban đầu của 2 cốc bằng nhau, t1 = 20°C, nhiệt độ của cốc (1) sau khi đun nóng là t2= 60°C, nhiệt độ cốc (2) không thay đổi và tốc độ phản ứng trong cốc (1) gấp 16 lần cốc (2). Khi đó ta có:
![]() \({\gamma ^{\frac{{60 - 20}}{{10}}}} = 16 \to \gamma = 2\)
\({\gamma ^{\frac{{60 - 20}}{{10}}}} = 16 \to \gamma = 2\)
- Vậy, khi nhiệt độ tăng lên 10°C, thì tốc độ phản ứng tăng 2 lần. Giá trị này là hệ số nhiệt độ Van't Hoff.
|
- Khi tăng nhiệt độ, tốc độ phản ứng tăng. - Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức:
Trong đó: vt1, vt2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; Quy tắc Vant Hoff chỉ gần đúng trong khoảng nhiệt độ không cao. |
|---|
3. Ảnh hưởng của áp suất
* Nghiên cứu ảnh hưởng của áp suất đến tốc độ phản ứng
- Trong phản ứng hoá học có sự tham gia của chất khí, áp suất có thể ảnh hưởng đến tốc độ phản ứng.
Ví dụ 2: Một trong những nghiên cứu nhằm giảm thiểu phát thải khí CO2 vào khí quyển gây hiệu ứng nhà kính, là chuyển CO2 thành sản phẩm có giá trị như methanol (CH3OH).
Phản ứng cần thực hiện ở áp suất cao, khoảng 58 – 103 bar để tăng tốc độ phản ứng. Phương trình hóa học của phản ứng:
CO2(g) + 3H2(g) → CH3OH(g) + H2O(g)
- Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.
| Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất. |
|---|
4. Ảnh hưởng của bề mặt tiếp xúc
a. Nghiên cứu ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
- Hóa chất: dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
- Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
- Tiến hành:
+ Bước 1: Cần khoảng 2 g CaCO3 mỗi loại, cho vào 2 bình tam giác (1), (2).
+ Bước 2: Đong khoảng 20 ml dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(1) + CO2(g)
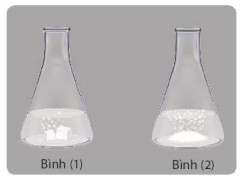
Hình 16.6. Minh hoạ thí nghiệm nghiên cứu ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
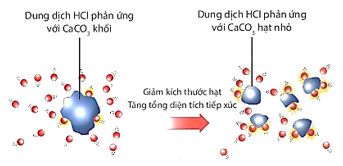
Hình 16.7. Minh hoạ dung dịch HCl phản ứng với CaCO3 có kích thước khác nhau
| Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng. |
|---|
5. Ảnh hưởng của chất xúc tác
- Với một số phản ứng hoá học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác, được ghi trên mũi tên trong phương trình hoá học.
* Nghiên cứu ảnh hưởng của xúc tác đến tốc độ phản ứng
- Thí nghiệm 3: Ảnh hưởng của xúc tác đến tốc độ phản ứng
- Hoá chất: dung dịch hydrogen peroxide (H2O2) 30%, bột MnO2
- Dụng cụ: ống nghiệm, tàn đóm đỏ.
- Tiến hành:
+ Bước 1: Rót khoảng 2 mL dung dịch H2O2 vào 2 ống nghiệm (1), (2).
+ Bước 2: Thêm một ít bột MnO2 vào ống nghiệm (2) và đưa nhanh tàn đóm đỏ vào miệng 2 ống nghiệm (Hình 16.8).
Phương trình hoá học của phản ứng:
2H2O2 (aq) → 2H2O (l) + O2 (g)

Hình 16.8. Thí nghiệm nghiên cứu ảnh hưởng của xúc tác đến tốc độ phản ứng
| Chất xúc tác làm tăng tốc độ của phản ứng hoá học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng. |
|---|
6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
* Tìm hiểu các yếu tố ảnh hưởng đến tốc độ phản ứng trong đời sống và sản xuất
- Vận dụng các yếu tố ảnh hưởng đến tốc độ phản ứng sẽ góp phần hiệu quả vào phục vụ đời sống, sản xuất, thúc đẩy quá trình diễn ra nhanh hơn hoặc hạn chế tốc độ của phản ứng, nhằm tối ưu hóa giá trị kinh tế.
| Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả. |
|---|
B. Bài tập minh họa
Bài 1: Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn (b), bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí(c),…
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên?
Hướng dẫn giải
(a) Ảnh hưởng của nhiệt độ
(b) Ảnh hưởng của áp suất
(c) Ảnh hưởng của nồng độ
Bài 2: Tìm một số thí dụ cho mỗi loại phản ứng nhanh và chậm mà em quan sát được trong cuộc sống và trong phòng thí nghiệm.
Hướng dẫn giải
Các ví dụ về loại phản ứng:
– Phản ứng nhanh: phản ứng nổ, sự đốt cháy các nhiên liệu (than, dầu, khí đốt,…) phản ứng giữa hai dung dịch AgNO3 và NaCl,…
– Phản ứng chậm: sự gỉ sắt, sự lên men rượu,…
Bài 3: Cho phản ứng hóa học: 2NO(k) + O2(k) → 2NO2(k)
Tốc độ phản ứng hóa học trên được tính theo công thức y = k [NO]2[O2]. Hỏi ở nhiệt độ không đổi, áp suất chung của hệ đã tăng bao nhiêu lần khi tốc độ của phản ứng tăng 64 lần?
Hướng dẫn giải
Đặt x là số lần tăng của áp suất. Theo bài ra ta có v2/v1 = 64 = x3 → x = 4.
Bài 4: Hãy cho biết các yếu tố ảnh hưởng đến tốc độ phản ứng như thế nào? Giải thích.
Hướng dẫn giải
Các yếu tố ảnh hưởng đến tốc độ phản ứng.
a) Ảnh hưởng của nồng độ: Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng. Giải thích: Điều kiện để các chất phản ứng với nhau là chúng phải va chạm vào nhau, tần số va chạm càng lớn thì tốc độ phản ứng càng lớn. Khi nồng độ các chất phản ứng tăng, tần số va chạm tăng nên tốc độ phản ứng tăng.
b) Ảnh hưởng của áp suất: Đối với phản ứng có chất khí, khi tăng áp suất, tốc độ phản ứng tăng.
Giải thích: Khi áp suất tăng, nồng độ các chất khí tăng tần số va chạm tăng nên tốc độ phản ứng tăng.
c) Ảnh hưởng của nhiệt độ: Khi tăng nhiệt độ, tốc độ phản ứng tăng.
Giải thích: Khi nhiệt độ tăng dần đến hai hệ quả sau:
– Tốc độ chuyển động của các phân tử tăng, dẫn đến tần số va chạm giữa các phân tử chất phản ứng tăng.
– Tần số va chạm có hiệu quả giữa các phân tử chất phản ứng tăng nhanh.
d) Ánh hưởng của diện tích bề mặt: Khi tăng diện tích bề mặt chất phản ứng, tốc độ phản ứng tăng.
Giải thích: Chất rắn với kích thước hạt nhỏ, có tổng diện tích bề mặt tiếp xúc với chất phản ứng lớn hơn so với chất rắn có kích thước lớn hơn và cùng khối lượng, nên tốc độ phản ứng lớn hơn.
e) Ảnh hưởng của chất xúc tác: Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng còn lại sau khi phản ứng kết thúc.
Giải thích: Chất xúc tác làm yếu liên kết giữa các nguyên tử của phân tử tham gia phản ứng làm biến đổi cơ chế phản ứng nên làm tăng tốc độ phản ứng.
C. Trắc nghiệm Hóa học 10 bài 16
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.










