Lý thuyết Hóa học 10 bài 10 CTST
VnDoc xin giới thiệu bài Lý thuyết Hóa lớp 10 bài 10: Liên kết cộng hóa trị được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách CTST. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Liên kết cộng hóa trị
A. Lý thuyết Hóa học 10 bài 10
1. Sự hình thành liên kết cộng hóa trị
a. Tìm hiểu sự hình thành liên kết trong các phân tử hydrogen chloride, oxygen và nitrogen
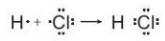
Hình 10.1. Sự hình thành liên kết trong phân tử HCl
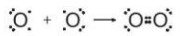
Hình 10.2. Sự hình thành liên kết trong phân tử O2
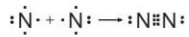
Hình 10.3. Sự hình thành liên kết trong phân tử N 2
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung
- Giữa nguyên tử hydrogen và nguyên tử chlorine trong phân tử HCl có một cặp electron chung, được biểu diễn bằng một gạch nối “-”, đó là liên kết đơn. Do đó liên kết trong phân tử HCl được biểu diễn là H-Cl.
- Giữa hai nguyên tử oxygen trong phần tử O, có hai cặp electron chung, được biểu diễn bằng hai gạch nối “=”, đó là liên kết đôi. Do đó liên kết trong phân tử O, được biểu diễn là O=O.
- Giữa hai nguyên tử nitrogen trong phân tử N, có ba cặp electron chung, được biểu diễn bằng ba gạch nối “≡”, đó là liên kết ba. Do đó liên kết trong phân tử N, được biểu diễn là ![]() \(N \equiv N.\)
\(N \equiv N.\)
- Các công thức H-Cl, O=O và N≡N gọi là công thức cấu tạo của HCl, O2 và N2
b. Tìm hiểu cách viết công thức Lewis
- Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phần tử. Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối"-".
Bảng 10.1. Công thức electron, công thức Lewis và công thức cấu tạo của một số phân tử
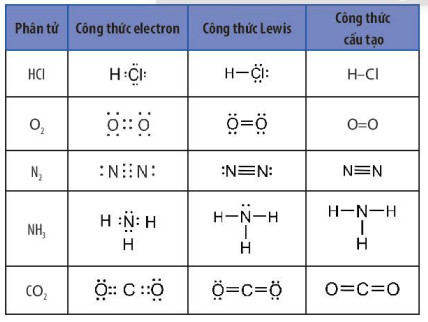
- Liên kết cộng hóa trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
2. Liên kết cho - nhận
a. Tìm hiểu khái niệm về liên kết cho – nhận
- Trong trường hợp cặp electron chung giữa hai nguyên tử tham gia liên kết chỉ do một nguyên tử đóng góp thì liên kết cộng hoá trị giữa hai nguyên tử là liên kết cho – nhận.
- Ví dụ 1: Trong phân tử H2O, nguyên tử oxygen còn 2 cặp electron chưa liên kết, ion H+ có orbital trống, không chứa electron. Khi cho H2O kết hợp với ion H+, nguyên tử oxygen sử dụng một cặp electron chưa liên kết làm cặp electron chung với ion H+ tạo thành ion hydronium (H3O+). Trong ion H3O+, nguyên tử oxygen đóng góp cặp electron chung nên là nguyên tử cho, ion H+ không đóng góp electron, đóng vai trò nhận electron. Tất cả các liên kết O-H trong ion H3O+ là tương đương nhau, nhưng để biểu diễn liên kết cho – nhận hiện diện trong ion, một mũi tên được hướng từ nguyên tử cho sang nguyên tử nhận để phân biệt với các liên kết còn lại.
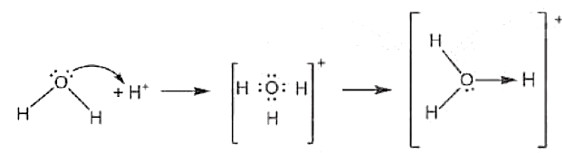
Công thức electron Công thức Lewis
Hình 10.4. Sơ đồ tạo liên kết cho nhận trong ion hydronium H3O+
- Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hoá trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
3. Phân biệt các loại liên kết dựa theo độ âm điện
a. Phân biệt liên kết cộng hoá trị phân cực và không phân cực
- Ta đã biết độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tham gia hình thành các liên kết hoá học.
- Trong Bảng 10.1, quan sát công thức electron của các phân tử, các cặp electron chung trong các phần tử O2, và N2, không lệch về phía nguyên tử nào, trong khi với các phân tử HCl, NH3 và CO2 cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
- Liên kết cộng hoá trị trong các phân tử O2, N2 là liên kết cộng hóa trị không phân cực, trong các phân tử HCl, NH3 và CO2 là liên kết cộng hóa trị phân cực.
|
Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào. Liên kết cộng hóa trị phân cực là liên kết cộng hoá trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. |
|---|
b. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
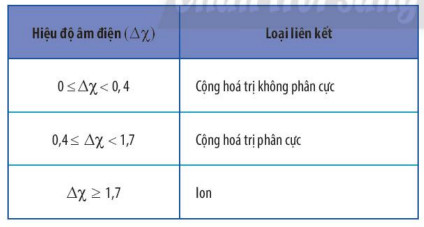
- Có thể dựa vào hiệu độ âm điện ![]() \((\Delta \chi )\) giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng theo Bảng 10.2.
\((\Delta \chi )\) giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng theo Bảng 10.2.
Bảng 10.2. Hiệu độ âm điện và loại liên kết tương ứng
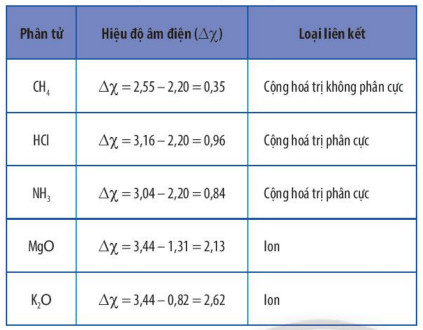
- Dựa vào giá trị độ âm điện trong bảng tuần hoàn (Hình 5.2 trang 37) để tính ![]() \(\Delta \chi\) và có thể dự đoán kiểu liên kết trong các phần tử.
\(\Delta \chi\) và có thể dự đoán kiểu liên kết trong các phần tử.
Bảng 10.3. Hiệu độ âm điện và loại liên kết trong một số phân tử
4. Sự hình thành liên kết σ , π và năng lượng liên kết
a. Tìm hiểu sự hình thành liên kết σ và liên kết π
- Liên kết cộng hoá trị được hình thành khi các orbital nguyên tử của hai nguyên tố xen phủ lẫn nhau. Sự xen phủ này có thể xảy ra theo hai cách là xen phủ trục và xen phủ bên, hình thành nên hai loại liên kết cộng hoá trị tương ứng là liên kết σ và liên kết π.
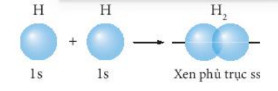
Hình 10.5. Sự xen phủ giữa hai orbital 1s của hai nguyên tử hydrogen hình thành liên kết σ trong phân tử hydrogen
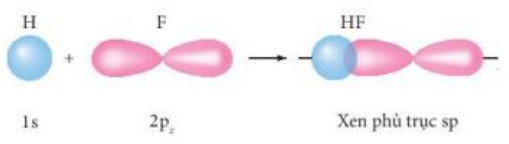
Hình 10.6. Sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 2p của nguyên tử fluorine hình thành liên kết σ trong phân tử hydrogen fluoride
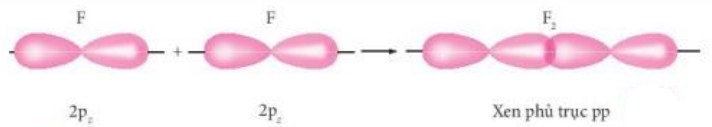
Hình 10.7. Sự xen phủ giữa orbital 2p của nguyên tử fluorine hình thành liên kết σ trong phân tử fluorine
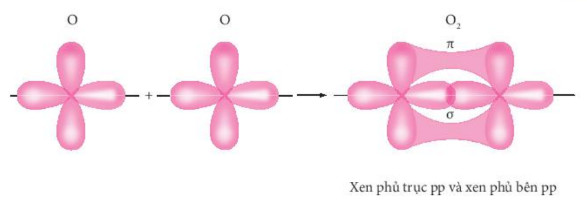
Hình 10.8. Sự xen phủ các AO hình thành liên kết σ và liên kếtπ trong phân tử oxygen
|
- Liên kết σ là loại liên kết cộng hoá trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử. - Liên kết π là loại liên kết cộng hoá trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ năm hai bên đường nội tâm hai nguyên tử. |
|---|
b. Tìm hiểu khái niệm năng lượng liên kết (Eb)
- Cho các phương trình phản ứng sau:
H2 (g) → 2H (g) Eb = 432 kJ/mol (1)
N2 (g) → 2N (g) Eb = 945 kJ/mol (2)
- Ta nói năng lượng liên kết Eb trong phân tử H2 và N2 lần lượt là 432 kJ/mol và 945 kJ/mol. Điều này có nghĩa cân cung cấp 432 kg và 945 kg để lần lượt phá vỡ 1 mol khí H2 và 1 mol khí N2 thành các nguyên tử ở thể khí.
- Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
- Đối với các phần tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ hoàn toàn 1 mol phân tử đó ở thể khi thành các nguyên tử thể khí.
Ví dụ: Tổng năng lượng liên kết trong phân tử CH4 là 1 660 kJ/mol.
CH4 (g) → C (g) + 4H (g) Eb = 1 660 kJ/mol
Do đó, năng lượng liên kết trung bình của một liên kết C-H là 1660 : 4 = 415 kJ/mol.
|
- Năng lượng của một liên kết hoá học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí. - Giá trị năng lượng của một liên kết hoá học là thước đo độ bền liên kết. |
|---|
c. Thực hành lắp ráp mô hình phân tử một số chất
- Bước 1: Xác định hình học phân tử của chất cần lắp ráp. Ví dụ phân tử methane (CH4) có dạng tứ diện đều, phân tử carbon dioxide (CO2) có dạng đường thẳng, ...
- Bước 2: Xác định số lượng các loại liên kết và kiểu liên kết trong phân tử, qua đó xác định số lượng mỗi loại khối cầu và số thanh nối cần dùng.
- Bước 3: Hoàn chỉnh mô hình phần tử.
B. Bài tập minh họa
Bài 1: Trong việc hình thành liên kết hoá học, không phải lúc nào các nguyên tử cũng cho, nhận các electron hoá trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hoá trị để cùng thỏa mãn quy tắc Octet. Trong trường hợp này, một loại liên kết hoá học mới được hình thành. Đó là loại liên kết gi?
Hướng dẫn giải
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị.
Bài 2: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đậy: AlCl3, CaCl2, CaS, Al2S3?
Hướng dẫn giải
Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cộng hóa trị có cực
CaS: 1,58.Liên kết cộng hóa trị có cực.
Al2S3: 0,97. Liên kết cộng hóa trị có cực.
Bài 3: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
C. Trắc nghiệm Hóa học 10 bài 10
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 10: Liên kết cộng hóa trị CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









