Tính chất hóa học của NH3
Tính chất hóa học NH3
Tính chất hóa học của NH3 được VnDoc biên soạn đưa ra nội dung về tính chất hóa học của amoniac cũng như các ví dụ phương trình hóa học minh họa giúp bạn đọc nắm được tính chất NH3 cũng như từ đó vận dụng vào giải các dạng câu hỏi bài tập liên quan. Mời các bạn tham khảo nội dung chi tiết dưới đây.
A. Công thức hóa học của amoniac
Amoniac bắt nguồn từ tiếng Pháp ammoniac và được phiên dịch ra tiếng việt là a-mô-ni-ắc.
Đây là một hợp chất vô cơ có công thức phân tử là NH3.
Amoniac là một hợp chất vô cơ được cấu tạo từ 3 nguyên tử nitơ và 1 nguyên tử hidro tạo thành liên kết kém bền
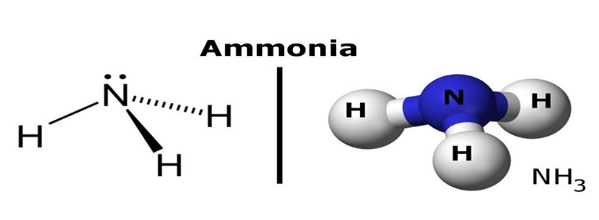
B. Tính chất vật lý của Amoniac
Amoniac thường tồn tại ở dạng khí, không màu, có mùi hôi khó chịu. Nồng độ Amoniac lớn có thể gây chết người.
Amoniac có độ phân cực lớn do phân tử NH3 có cặp electron tự do và liên kết N–H bị phân cực. Do đó NH3 là chất dễ hoá lỏng.
Dung dịch Amoniac là dung môi hoà tan tốt: NH3 hoà tan các dung môi hữu cơ dễ hơn nước do có hằng số điện môi nhỏ hơn nước.
Kim loại kiềm và các kim loại Ca, Sr, Ba có thể hòa tan trong NH3 lỏng tạo dung dịch xanh thẫm.
C. Tính chất hóa học của NH3
1. Amoniac có tính bazơ yếu
Amoniac do tính bazơ nên dung dịch amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng.
Do đó để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
a) Amoniac phản ứng với nước
NH3 + H2O ⇔ NH4+ + OH-
b) Amoniac phản ứng với Axit → Muối Amoni
Thí dụ:
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
c) Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối
NH3 + Muối (dung dịch) → Bazơ + Muối mới
Thí dụ
2NH3 + MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3 + 3H2O →Al(OH)3↓ + 3NH4Cl
* Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan
Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
Thí dụ:
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2↓ + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)3](OH)2
2. Amoniac có tính khử mạnh
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
a) Amoniac tác dụng với O2
4NH3 + 3O2 ![]() \(\overset{t^{o} }{\rightarrow}\) 2N2↑ + 6H2O
\(\overset{t^{o} }{\rightarrow}\) 2N2↑ + 6H2O
4NH3 + 5O2 ![]() \(\overset{800^{o}C,Pt }{\rightarrow}\) 4NO↑ + 6H2O
\(\overset{800^{o}C,Pt }{\rightarrow}\) 4NO↑ + 6H2O
b) Amoniac tác dụng với Cl2
2NH3 + 3Cl2 ![]() \(\overset{t^{o} }{\rightarrow}\) N2↑ + 6HCl
\(\overset{t^{o} }{\rightarrow}\) N2↑ + 6HCl
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
c) Amoniac tác dụng với oxit của kim loại
Thí dụ:
3CuO + 2NH3 ![]() \(\overset{t^{o} }{\rightarrow}\)Cu + 3H2O + N2↑
\(\overset{t^{o} }{\rightarrow}\)Cu + 3H2O + N2↑
3. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
D. Điều chế Amoniac
1. Điều chế NH3 trong công nghiệp
Tổng hợp từ N2 và H2
N2 + 3H2 ![]() \(\overset{t^{o} }{\rightarrow}\)2NH3 (4500C; Fe, p)
\(\overset{t^{o} }{\rightarrow}\)2NH3 (4500C; Fe, p)
2. Điều chế amoniac trong phòng thí nghiệm
- Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
- Nhiệt phân muối amoni
NH4Cl ![]() \(\overset{t^{o} }{\rightarrow}\) NH3 + HCl
\(\overset{t^{o} }{\rightarrow}\) NH3 + HCl
NH4HCO3 ![]() \(\overset{t^{o} }{\rightarrow}\) NH3 + H2O + CO2
\(\overset{t^{o} }{\rightarrow}\) NH3 + H2O + CO2
D. Bài tập vận dụng liên quan
Câu 1: Tìm phát biểu đúng
A. NH3 là chất Oxi hóa mạnh
B. NH3 có tính khử mạnh, tính Oxi hóa yếu
C. NH3 là chất khử mạnh
D. NH3 có tính Oxi hóa mạnh, tính khử yếu
Câu 2: Tìm phát biểu chưa đúng
A. Các muối amoni đều dễ tan trong nước
B. Các muối amoni khi tan đều điện li hoàn toàn thành ion
C. Các muối amoni khi đun nóng đều bị phân hủy thành amoniac và Axit
D. Có thể dùng muối amoni để đều chế NH3 trong phòng thí nghiệm
Câu 3: Sản phẩm của phản ứng nhiệt phân NaNO3 :
A. Na2O, NO2 và O2
B. Na, NO2, O2
C. NaNO2, NO2 và O2
D. NaNO2 và O2
Câu 4: Chọn phát biểu đúng
A. Các muối amoni đều lưỡng tính
B. Các muối amoni đều thăng hoa
C. Urê cũng là muối amoni
D. Phản ứng nhiệt phân NH4NO3 là phản ứng tự oxi hóa, tự khử
Câu 5: Khí nào có tính gây cười?
A. N2O5
B. NO
C. N2O
D. NO2
Câu 6. Chọn câu đúng nhất trong các câu sau :
A. Dung dịch NH3 hoà tan Cu(OH)2 do tạo phức [Cu(NH3)4]2+
B. Dung dịch NH3 hoà tan Zn(OH)2 do Zn(OH)2 lưỡng tính
C. Dung dịch muối nitrat có tính oxi hóa
D. Dung dịch muối nitrat kém bền với nhiệt và có tính oxi hóa ở nhiệt độ cao.
Câu 7. Chỉ dùng dung dịch NH3 có thể nhận biết được dãy chất nào sau đây?
A. AlCl3, MgCl2, NaCl
B. ZnCl2, MgCl2, KCl
C. HCl, H2SO4, Na2SO4
D. CuCl2, Ba(NO3)2, (NH4)2SO4
........................................
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết Tính chất hóa học của NH3, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11...
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.



