Đề thi Olympic môn Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi Olympic môn Hóa học lớp 11
Đề thi Olympic môn Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017 là đề thi học sinh giỏi cấp trường lớp 11 môn Hóa có đáp án đi kèm. Hy vọng rằng, bộ sưu tập này sẽ giúp các bạn học sinh củng cố kiến thức và trau dồi kinh nghiệm hữu ích để làm bài. Chúc các bạn thành công.
Đề thi Olympic Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm 2014 - 2015
Đề thi Olympic tháng 4 TP. HCM lần 1 môn Hóa học lớp 11 năm 2015
Đề thi học sinh giỏi môn Hóa học lớp 11 tỉnh Nghệ An năm học 2015 - 2016
|
Trường THPT Đa Phúc |
ĐỀ THI OLYMPIC |
|
Năm học: 2016-2017 |
Môn: Hóa học 11 |
|
---------š&›---------- |
Thời gian làm bài: 90 phút (Đề thi gồm 2 trang) |
Câu 1. (5,0 điểm)
1. Chỉ dùng một dung dịch làm thuốc thử, hãy lập sơ đồ để nhận biết 4 dung dịch riêng biệt chứa các chất sau: K3PO4, KCl, KNO3, K2S (không cần ghi phản ứng).
2. Có các dung dịch cùng nồng độ chứa các chất sau: Al2(SO4)3, HNO3, KNO3, Na2CO3. Hãy cho biết dung dịch có pH nhỏ nhất và giải thích?
3. a) Viết các phương trình phản ứng điều chế trực tiếp các chất: N2, HNO3, H3PO4 trong phòng thí nghiệm và phân ure trong công nghiệp.
b) Hoàn thành các phương trình phản ứng sau:
K2SO3 + KMnO4 + KHSO4 →
KMnO4 + FeCl2 + H2SO4 → Dung dịch chỉ chứa muối sunfat
Câu 2. (6,0 điểm)
1. Từ quặng photphorit, có thể điều chế được axit photphoric theo sơ đồ sau:
Quặng photphorit → P → P2O5 → H3PO4.
Viết các phương trình phản ứng xảy ra và tính khối lượng quặng photphorit chứa 73% Ca3(PO4)2 cần để điều chế 1 tấn dung dịch H3PO4 50%. Giả sử hiệu suất của mỗi giai đoạn đều đạt 90%.
2. Cho hỗn hợp A gồm FeS và FeCO3 tác dụng với dung dịch HNO3 đặc nóng dư, phản ứng hoàn toàn, thu được dung dịch A1 chỉ chứa Fe(NO3)3, H2SO4 và HNO3 dư; hỗn hợp B gồm 2 khí là X và Y có tỉ khối so với H2 bằng 22,8.
Viết các phương trình phản ứng và tính phần trăm theo khối lượng mỗi muối trong A.
3. Khi cho cùng một lượng kim loại M vào dung dịch HNO3 đặc nóng dư và dung dịch H2SO4 loãng dư, phản ứng hoàn toàn thì thể tích khí NO2 (sản phẩm khử duy nhất) thu được gấp 3 lần thể tích khí H2 ở cùng điều kiện nhiệt độ và áp suất. Khối lượng muối sunfat thu được bằng 62,81% khối lượng muối nitrat tạo thành. Xác định kim loại M.
4. Photgen là một chất khí độc được điều chế theo phản ứng: CO(k) + Cl2(k) → COCl2(k)
Số liệu thực nghiệm tại 20oC về động học phản ứng này như sau:
|
Thí nghiệm |
[CO] ban đầu (mol/lít) |
[Cl2] ban đầu (mol/lít) |
Tốc độ ban đầu (mol/lít.s) |
|
1 |
1,00 |
0,10 |
1,29.10-29 |
|
2 |
0,10 |
0,10 |
1,33.10-30 |
|
3 |
0,10 |
1,00 |
1,30.10-29 |
|
4 |
0,10 |
0,01 |
1,32.10-31 |
a) Hãy viết biểu thức tốc độ phản ứng.
b) Nếu [CO] ban đầu là 1,00 mol/lít và [Cl2] ban đầu 0,10 mol/lít, thì sau thời gian bao lâu [Cl2] còn lại 0,08 mol/lít.
Câu 3. (5,0 điểm)
1. Cho hỗn hợp gồm CaCO3, Fe3O4 và Al chia làm 2 phần. Phần 1 tác dụng với dung dịch HNO3 loãng dư, tạo sản phẩm khử là NO duy nhất. Phần 2 tác dụng dung dịch NaOH dư thu được chất rắn. Chia đôi chất rắn, rồi cho tác dụng lần lượt với dung dịch H2SO4 loãng dư và CO dư, nung nóng. Viết các phương trình phản ứng xảy ra, biết các phản ứng xảy ra hoàn toàn.
2. Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các trường hợp sau:
a) Cho đồng kim loại vào dung dịch hỗn hợp NH4NO3 và H2SO4 loãng.
b) Sục khí NH3 từ từ đến dư vào dung dịch ZnCl2.
c) Cho dung dịch KHSO4 đến dư vào dung dịch Ba(HCO3)2.
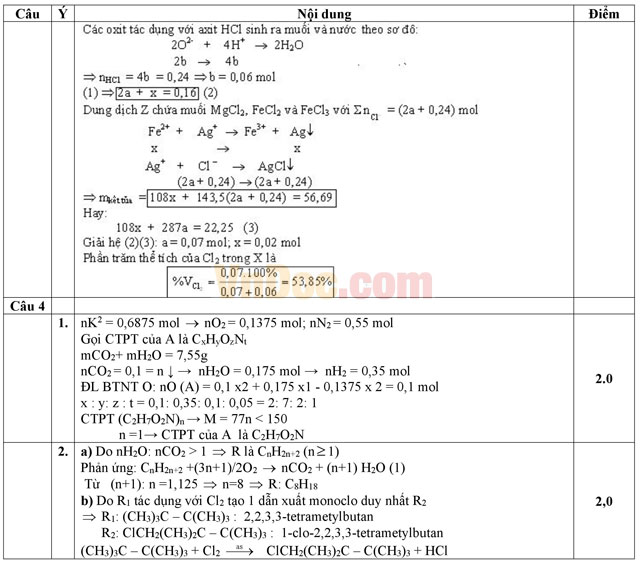
3. Hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe phản ứng vừa hết với hỗn hợp khí X gồm clo và oxi thu được hỗn hợp Y chỉ gồm các oxit và muối clorua. Hòa tan Y cần dùng một lượng vừa đủ là 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, phản ứng hoàn toàn, thu được 56,69 gam kết tủa. Tính phần trăm theo thể tích của khí clo trong hỗn hợp X.
Câu 4. (4,0 điểm)
1. Đốt cháy hoàn toàn m gam chất hữu cơ A cần dùng vừa đủ 15,4 lít không khí ở đktc thu được hỗn hợp B gồm CO2, H2O và N2. Dẫn hỗn hợp B vào bình đựng Ca(OH)2 dư thu được 10 gam kết tủa, khối lượng bình nước vôi tăng 7,55 gam và thoát ra 12,88 lít khí ở đktc. Trong không khí N2 chiếm 80% và PTK của chất hữu cơ nhỏ hơn 150u. Xác định CTPT của A.
2. Đốt cháy hoàn toàn hiđrocacbon R, thu được tỉ lệ số mol H2O và CO2 tương ứng bằng 1,125.
a) Xác định công thức phân tử của R.
b) R1 là đồng phân của R, khi tác dụng với Cl2, điều kiện thích hợp, tỉ lệ mol 1:1 thì thu được một dẫn xuất mono clo duy nhất (R2). Gọi tên R1, R2 và viết phương trình phản ứng xảy ra.
Cho: H = 1, O = 16, Na = 23, Mg = 24, P = 31, Cl = 35,5; K = 39, Ca = 40, Fe = 56, Ag = 108, I = 127.
-----------------------Hết-----------------------
Chú ý: Thí sinh không được dùng bảng HTTH và tính tan.
Đáp án đề thi Olympic môn Hóa học lớp 11