Đề thi Olympic tháng 4 TP. HCM lần 1 môn Hóa học lớp 11 năm 2015
Đề thi Olympic môn Hóa học lớp 11
Đề thi Olympic tháng 4 TP. HCM lần 1 môn Hóa học lớp 11 năm 2015 được làm bài trong thời gian 150 phút, gồm 4 câu hỏi lớn, đây là tài liệu ôn tập hữu ích dành cho các bạn học sinh lớp 11, giúp các bạn ôn tập chương trình Hóa học nâng cao, từ đó, chuẩn bị bài thi, bài kiểm tra môn Hóa hiệu quả.
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO THÀNH PHỐ HỒ CHÍ MINH Môn thi: HOÁ HỌC 11 Đề thi chính thức Đề thi có 2 trang |
KỲ THI OLYMPIC THÁNG 4 TP. HCM LẦN 1 NĂM HỌC 2014 - 2015 Thời gian: 150 phút (không kể thời gian phát đề) Ngày 04 tháng 4 năm 2015
|
Câu 1: (5 điểm)
1.1 Hoàn thành các phản ứng sau:
a. A + B → D + H2O b. A + E → F + CO2 + H2O
c. A + G → H↓ + B + H2O d. A + I → D + J + H2O
e. A → D + CO2 + H2O f. A + K → L + M + CO2 + H2O
Biết A là hợp chất của Na.
1.2. Bằng phương pháp hóa học, hãy nhận biết 5 dung dịch muối sau chỉ dùng một thuốc thử: dd NaCl; dd AlCl3; dd FeCl3; dd CuCl2; dd ZnCl2.
1.3. Từ quặng photphoric và các điều kiện có đủ, viết phương trình phản ứng điều chế: P, suppephotphat đơn và suppe photphat kép. Tính độ dinh dưỡng của suppe photphat kép.
Câu 2: (5 điểm)
2.1. Công thức phân tử chung của 3 chất hữu cơ (X), (Y), (T) đều có dạng (CH)n.
Biết rằng:
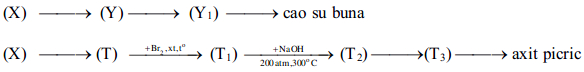
Xác định công thức cấu tạo của 3 chất (X), (Y), (T) và viết các phương trình phản ứng .
2.2. Có phản ứng sau: X + H2 (dư) 3-metylbutan-1-ol. Xác định các công thức có thể có của X và viết các phản ứng xảy ra.
2.3. X là chất hữu cơ, đốt cháy X chỉ thu được CO2 và H2O biết MX < 60. Mặt khác khi cho X tác dụng với AgNO3/NH3 (dư) thì tỷ lệ mol phản ứng là nX: nAgNO3 = 1:2. Viết các công thức cấu tạo có thể có của X.
Câu 3: (5 điểm)
3.1. Đốt cháy hoàn toàn 4,4 gam sunfua của kim loại M (công thức MS) trong oxi dư. Chất rắn sau phản ứng đem hòa tan trong một lượng vừa đủ dung dịch HNO3 37,8% thấy nồng độ phần trăm của muối trong dung dịch thu được là 41,72%. Khi làm lạnh dung dịch này thì thoát ra 8,08 gam muối rắn. Lọc tách muối rắn thấy nồng độ phần trăm của muối trong dung dịch là 34,7%. Xác định công thức của muối rắn.
3.2. Hòa tan x gam hỗn hợp bột gồm 2 kim loại Mg và Al vào y gam dung dịch HNO3 24%. Sau phản ứng thu được dung dịch A và 0,896 lít hỗn hợp X gồm 3 khí không màu có khối lượng 1,32 gam. Thêm một lượng O2 vừa đủ vào X, phản ứng xong thu được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch NaOH dư thấy còn lại khí Z (có tỉ khối hơi của Z so với H2 bằng 18). Nếu cho từ từ dung dịch NaOH vào dung dịch A đến khi thu được lượng kết tủa lớn nhất thấy cân nặng 6,42 gam (không có khí thoát ra). Tính x và y biết rằng HNO3 đã lấy dư 15% so với lượng cần thiết, các thể tích khí đều đo ở điều kiện tiêu chuẩn và các phản ứng đều xảy ra hoàn toàn.
Câu 4: (5 điểm)
4.1. Oxi hóa 0,08 mol một ancol đơn chức, thu được hỗn hợp X gồm một axit cacboxylic, một andehyt, ancol dư và nước. Ngưng tụ toàn bộ X rồi chia làm hai phần bằng nhau. Phần một cho tác dụng hết với Na dư thu được 0,504 lít khí H2 (đktc). Phần hai cho phản ứng tráng Ag hoàn toàn thu được 9,72 gam Ag. Phần trăm khối lượng ancol bị oxi hóa là?
4.2. A là axit hữu cơ mạch không phân nhánh, B là ancol đơn chức bậc 1 có nhánh. Khi trung hòa hoàn toàn A cần số mol NaOH gấp 2 lần số mol A. Khi đốt cháy B được CO2 và H2O với tỉ lệ số mol 4:5. Khi cho 0,1 mol A tác dụng với 0,25 mol B với hiệu suất 73,5% thu được 14,847 gam chất hữu cơ E.
1) Viết công thức cấu tạo của A, B, E.
2) Tính khối lượng axit A và ancol B đã tham gia phản ứng.
Đáp án đề thi Olympic môn Hóa học lớp 11
Câu 1.1:
a. NaHCO3 + NaOH → Na2CO3 + H2O
A B D
b. NaHCO3 + HCl → NaCl + CO2 + H2O
E F
c. NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O
G H
d. 2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O
I J
e. 2NaHCO3 → Na2CO3 + CO2 + H2O
f. 2NaHCO3 + 2KHSO4 → Na2SO4 + K2SO4 + 2CO2 + 2H2O
K L M
Học sinh không cần xác định A, B, D..........
Câu 1.2:
| NaCl | AlCl3 | FeCl3 | CuCl2 | ZnCl2 | |
| Dd NH3 | - | Kết tủa trắng |
Kết tủa nâu đỏ | Kết tủa xanh | Kết tủa trắng |
| Dd NH3 dư | 1 | Không tan | 2 | 3 |
Tan (4) |
Các phương trình:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
FeCl3 + 3NH3 + 3H2O → Fe(OH)3 + 3NH4Cl
CuCl2 + 2NH3 + 2H2O → Cu(OH)2 + 2NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + 4NH3 Zn(NH3)4(OH)2
Dùng thuốc thử khác không cho điểm
Câu 1.3:
Các phản ứng điều chế:
Ca3(PO4)2 + SiO2 + 2C → 3CaSiO3 + 2CO + 2P
Ca3(PO4)2 + 2H2SO4đ → Ca(H2PO4)2 + 2CaSO4
Ca3(PO4)2 + 3H2SO4đ → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 3Ca(H2PO4)2
Supephotphatkep Ca(H2PO4)2 P2O5
234 142
Độ dinh dưỡng là: (142 : 234).100 = 60,68%