Đề thi Olympic Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm 2014 - 2015
Đề thi Olympic Hóa học lớp 11 có đáp án
Đề thi Olympic Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm 2014 - 2015 được VnDoc.com sưu tầm và đăng tải, là tài liệu ôn tập môn Hóa nâng cao dành cho các bạn học sinh lớp 11, giúp các bạn luyện tập và hệ thống lại kiến thức môn Hóa hiệu quả. Mời các bạn tham khảo.
Đề thi học sinh giỏi lớp 11 THPT tỉnh Thái Nguyên
|
SỞ GD & ĐT HÀ NỘI TRƯỜNG THPT ĐA PHÚC |
ĐỀ THI OLYMPIC HÓA HỌC LỚP 11 NĂM HỌC 2014 - 2015 (Thời gian làm bài 90 phút) |
Câu 1: (2 điểm) Giải thích tại sao
1). NF3 không có tính bazơ như NH3.
2). NO2 dễ dàng nhị hợp còn CO2 và ClO2 thì không thể.
Câu 2: (3 điểm)
1). Hoàn thành các phưong trình phản ứng sau:
a/ Cl2 + dd FeSO4 → e/ Fe + KNO3 + HCl →
b/ NaHCO3 + dd Ba(OH)2 dư → f/ KI + FeCl3 →
c/ Al + NaNO3 + dd NaOH → g/ I2 + Na2S2O3 →
d/ FeS2 + dd HCl →
2). Cân bằng các phản ứng sau theo phương pháp thăng bằng electron:
a/ K2SO3 + KMnO4 + KHSO4 → K2SO4 + MnSO4 ...
b/. P + NH4ClO4 → H3PO4 + N2 + Cl2 +...
c/.FeS + H+ + NO-3 → SO42- + N2Ox...
Câu 3: (3 điểm)
1). Cho biết hiện tượng, viết phương trình phản ứng minh hoạ khi cho từ từ đến dư dung dịch Na2CO3 vào dung dịch AlCl3?
2). Tính pH của dung dịch CH3COONa nồng độ 0,1M biết CH3COOH có Ka = 10-4,74 .
Câu 4: (2 điểm) Cho từ từ từng giọt dung dịch A chứa 0,4 mol HCl vào dung dịch B chứa 0,3 mol Na2CO3 và 0,15 mol KHCO3 thu được dung dịch D và V lit CO2 (đktc)
1). Tính V?
2). Tính khối lượng kết tủa thu được khi cho dung dịch Ca(OH)2 dư vào dung dịch D?
Câu 5: (4 điểm) Cho m1 gam hỗn hợp gồm Mg, Al vào m2 gam dung dịch HNO3 24%. Sau khi các kim loại tan hết có 8,96 lít (ở đktc) hỗn hợp khí X gồm NO, N2O, N2 bay ra (ở đktc) và dung dịch A. Thêm một lượng vừa đủ O2 vào X, sau phản ứng thu được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch NaOH dư có 4,48 lít hỗn hợp khí Z đi ra (ở đktc). Tỷ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào A để được lượng kết tủa lớn nhất thu được 62,2 gam kết tủa. Tính m1, m2. Biết lượng HNO3 lấy dư 20% so với lượng cần thiết.
Câu 6: (4 điểm) Hỗn hợp khí A ở đktc gồm hai olefin. Đốt cháy hết 7 thể tích khí A cần 31 thể tích oxi.
1). Tìm CTPT của hai olefin biết rằng olefin chứa nhiều C hơn chiếm khoảng 40 – 50% thể tích A?
2). Tính %KL mỗi olefin
3). Trộn 4,074 lít A với V lít hiđro rồi đun nóng với Ni. Hỗn hợp khí sau pư cho qua từ từ dd nước brom thấy nước brom nhạt màu và khối lượng bình tăng 2,8933 gam. Tính thể tích hiđro đã dùng và tính khối lượng phân tử trung bình của hh ankan thu được.
Biết các khí đo ở đktc, các pư xảy ra hoàn toàn và hiệu suất pư của hai olefin như nhau.
Câu 7: (2 điểm) Hòa tan hết hỗn hợp FeS và FeCO3 bằng dung dịch HNO3 được hỗn hợp khí A gồm 2 khí X và Y có tỉ khối so với H2 bằng 22,805.
1). Tính %m mỗi muối trong hỗn hợp ban đầu?
2). Làm lạnh A được hỗn hợp B gồm X, Y, Z có tỉ khối so với H2 bằng 30,61. Tinh %X bị đime hóa?
Đáp án đề thi Olympic Hóa học lớp 11
Câu 1:
1/ NH3 có tính bazơ là do trên N có đôi e tự do khi gặp H+ thì đôi e này kết hợp với H+ => NH3 có tính bazơ; trong NF3 thì đôi e tự do bị giữ chặt vì F có độ âm điện lớn hút đôi e này về phía nó do đó NF3 không có khả năng cho e kết hợp với H+ hay nó không có tính bazơ.
2/ Vì N trong NO2 có 1e độc thân nên NO2 dễ kết hợp với nhau để e này được ghép đôi vì thế mà NO2 dễ nhị hợp (hai phân tử kết hợp với nhau)
+ CO2 và ClO2 không có e độc thân nên không nhị hợp được.
Câu 2:
1/
a/ 3Cl2 + 6FeSO4 → 2FeCl3 + 2Fe2(SO4)3.
b/ 2NaHCO3 + Ba(OH)2 → Na2CO3 + BaCO3 + 2H2O
c/ 8Al + 3NaNO3 + 5NaOH + 2H2O → 8NaAlO2 + 3NH3.
d/ FeS2 + 2HCl → FeCl2 + S + H2O
2/
a. 5K2SO3 + 2KMnO4 +6KHSO4 → 9K2SO4 + 2MnSO4 + 3H2O
b/ 8P + 10NH4ClO4 → 8H3PO4 + 5N2 + 5Cl2 + 8H2O
Ta có NH4ClO4 có cả chất cho và nhận e thì ta phải tính xem là cả phân tử NH4ClO4 là cho hay nhận.
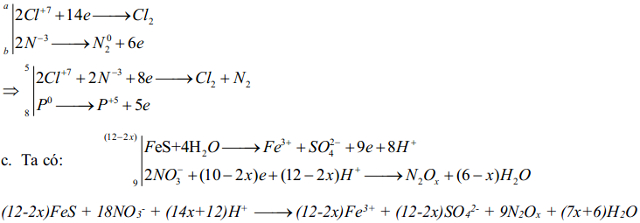
Câu 3:
1/ Hiện tượng: Sủi bọt khí và kết tủa trắng, dạng keo xuất hiện rồi từ từ tan
Giải thích: - Môi trường của dung dịch Na2CO3 là môi trường ba zơ, môi trường của dung dịch AlCl3 là môi trường axit. Khi cho từ từ dung dịch Na2CO3 vào một môi trường axit, bọt khí xuất hiện, kết tủa xuất hiện nhưng là Al(OH)3.
3Na2CO3 + 3H2O + 2AlCl3 → 2Al(OH)3 + 3CO2 + 6NaCl
Sau, tiếp tục cho vào thì kết tủa tan dần theo phản ứng:
Na2CO3 + Al(OH)3 → NaAlO2 + NaHCO3 + H2O
2/ pH = 8,87.
(Còn tiếp)