Giải bài tập Hóa học 12 SBT bài 35
Hóa học 12 - Đồng và hợp chất của đồng
VnDoc xin giới thiệu tới các bạn tài liệu Giải bài tập Hóa học 12 SBT bài 35. Nội dung tài liệu sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh giải Hóa 12 một cách nhanh và chính xác hơn. Mời các bạn tham khảo.
Giải bài tập Hóa học 12 SBT
Bài 7.71, 7.72, 7.73 trang 83 sách bài tập (SBT) Hóa học 12
7.71. Trong phòng thí nghiệm, để điểu chế CuSO4 người ta cho Cu tác dụng với dung dịch nào sau đây
A. H2SO4 đậm đặc
B. H2SO4 loãng.
C. Fe2(S04)3 loãng.
D. FeSO4 loãng.
7.72. Có các dung dịch: HCl, HNO3, NaOH, AgNO3, NaNO3. Chỉ dùng thêm chất nào sau đây để nhận biết các dung dịch trên
A. Cu.
B. Dung dịch Al2(SO4)3.
C. Dung dịch BaCl2.
D. Dung dịch Ca(OH)2.
7.73. Ba hỗn hợp kim loại (1) Cu-Ag, (2) Cu- Al, (3) Cu -Mg
Dung dịch của cặp chất nào sau đây để nhận biết cac hỗn hợp trên
A. HCl và AgNO3
B. HCl và Al(NO3)3
C. HCl và Mg(NO3)2
D. HCl và NaOH
Hướng dẫn trả lời:
7.71. A
7.72. A
7.73. D
7.72. Chọn A
Cho Cu vào các dung dịch trên:
- Không có phản ứng là: HCl, NaIH, NaNO3.
- Có phản ứng là:
+ 3Cu + 8HNO3 ⟶ 3Cu(NO3)2 +2NO↑ + 4H2O
Khí NO hóa nâu trong không khí:
2NO + O2 ⟶ 2NO2
+ Cu + 2AgNO3 ⟶ Cu(NO3)2 +2Ag↓
- Lấy dung dịch AgNO3 để nhận ra dung dịch HCl (Kết tủa AgCl trắng), nhận ra dung dịch NAOH (Kết tủa Ag2O đen)
- Còn lại là dung dịch NaNO3.
7.73. Chọn D
- Cho từng hỗn hợp tác dụng với dung dịch HCl nhận ra hỗn hợp Cu - Ag không tác dụng.
- Hỗn hợp (2) tạo ta dung dịch AlCl3 và hỗn hợp (3) tạo ra dung dịch MgCl. phân biệt bằng dung dịch NaOH:
AlCl3 + 3NaOH ⟶ Al(OH)3↓ +3NaCl
tan trong NaOH dư
MgCl2 + 2NaOH ⟶ Mg(OH)2↓ + 2NaC
không tan trong NaOH dư.
Bài 7.74, 7.75, 7.76. 7.77 trang 84 sách bài tập (SBT) Hóa học 12
7.74. Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (Giả sử hiệu suất của các phản ứng là 100%) là
A. 24 g.
B. 26 g.
C. 28 g.
D. 30 g.
7.75. Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muôi khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
A. 26,8 g.
B. 13,4 g.
C. 37,6 g.
D. 34,4 g.
7.76. Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí 02 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
7.77. Cho sơ đồ chuyển hoá quặng đồng thành đồng:
![]() \(CuFe{S_2}\buildrel { + {O_2},{t^0}} \over\longrightarrow X\buildrel { + {O_2},{t^0}} \over\longrightarrow Y\buildrel { + X,{t^0}} \over\longrightarrow Cu\)
\(CuFe{S_2}\buildrel { + {O_2},{t^0}} \over\longrightarrow X\buildrel { + {O_2},{t^0}} \over\longrightarrow Y\buildrel { + X,{t^0}} \over\longrightarrow Cu\)
Hai chất X, Y lần lượt là
A. Cu2O, CuO.
B. CuS, CuO.
C. Cu2S, CuO.
D. Cu2S, Cu2O
Hướng dẫn trả lời:
7.74. C
7.75. C
7.76. B
7.77. D
7.74. Chọn C
![]() \({n_{{H_2}}} = {n_{Cu}} = {n_{F{\rm{e}}}} = {{32} \over {64}} = 0,5\left( {mol} \right)\)
\({n_{{H_2}}} = {n_{Cu}} = {n_{F{\rm{e}}}} = {{32} \over {64}} = 0,5\left( {mol} \right)\)
![]() \({m_{F{\rm{e}}}} = 56.0,5 = 28\left( g \right)\)
\({m_{F{\rm{e}}}} = 56.0,5 = 28\left( g \right)\)
7.75. Chọn C
![]() \(A{g_2}O \to 2AgN{O_3} \to 2Ag\)
\(A{g_2}O \to 2AgN{O_3} \to 2Ag\)
0,1 0,2 0,2(mol
![]() \({m_{Ag}} = 108.0,2 = 21,6\left( g \right)\)
\({m_{Ag}} = 108.0,2 = 21,6\left( g \right)\)
![]() \(Cu \to Cu{\left( {N{O_3}} \right)_2} \to CuO\)
\(Cu \to Cu{\left( {N{O_3}} \right)_2} \to CuO\)
0,2 0,2 0,2(mol)
![]() \({m_{Cu}} = 80.0,2 = 16\left( g \right)\)
\({m_{Cu}} = 80.0,2 = 16\left( g \right)\)
Vậy khối lượng chất rắn B là: 21,6 + 16 = 37,6 (g).
7.76. Chọn B
- Phương pháp thông thường:
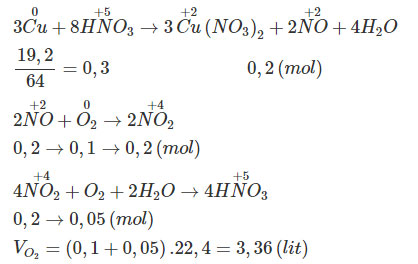
- Phương pháp bảo toàn electron:
Trong quá trình phản ứng trên thì Cu nhường electron và O2 thu electron. Còn N+5 trong HNO3 chỉ vận chuyển electron nên ta có:
Quá trình nhường electron:
![]() \(Cu \to C{u^{2 + }} + 2{\rm{e}}\)
\(Cu \to C{u^{2 + }} + 2{\rm{e}}\)
0,3 0,6(mol)
Quá trình thu electron:
![]() \({O_2} + 4{\rm{e}} \to 2{{\rm{O}}^{2 - }}\)
\({O_2} + 4{\rm{e}} \to 2{{\rm{O}}^{2 - }}\)
0,3 →4x(mol)
Ta có:
![]() \(4x = 0,6 \Rightarrow x = {{0,6} \over 4} = 0,15\left( {mol} \right)\)
\(4x = 0,6 \Rightarrow x = {{0,6} \over 4} = 0,15\left( {mol} \right)\)
![]() \(\Rightarrow {V_{{O_2}}} = 0,15.22,4 = 3,36\) (lít)
\(\Rightarrow {V_{{O_2}}} = 0,15.22,4 = 3,36\) (lít)
Bài 7.78, 7.79, 7.80, 7.81, 7.82, 7.83 trang 85 sách bài tập (SBT) Hóa học 12
7.78. Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là
A. Cu(NO3)2.
B. HNO3.
C. Fe(NO3)2.
D. Fe(NO3)3.
7.79. Cho các phản ứng:
![]() \((1)C{u_2}O + C{u_2}S\buildrel {{t^0}} \over\longrightarrow\)
\((1)C{u_2}O + C{u_2}S\buildrel {{t^0}} \over\longrightarrow\)
![]() \((2)Cu{(N{O_3})_2}\buildrel {{t^0}} \over\longrightarrow\)
\((2)Cu{(N{O_3})_2}\buildrel {{t^0}} \over\longrightarrow\)
![]() \((3)CuO + CO\buildrel {{t^0}} \over\longrightarrow\)
\((3)CuO + CO\buildrel {{t^0}} \over\longrightarrow\)
![]() \((4)CuO + N{H_3}\buildrel {{t^0}} \over\longrightarrow\)
\((4)CuO + N{H_3}\buildrel {{t^0}} \over\longrightarrow\)
Số phản ứng tạo ra kim loại Cu là
A. 2.
B.3.
C. 1
D. 4
7.80. Nhận định nào sau đây không đúng?
A. Cu là kim loại chuyển tiếp, thuộc nhóm IB, chu kì 4, ô số 29 trong bảng tuần hoàn.
B. Cu là nguyên tố s, có cấu hình electron: [Ar]3d1094s1.
C. Cấu hình electron của ion Cu+ là [Ar]3d,10 và Cu2+ là [Ar]3d9.
D. So với kim loại nhóm IA, liên kết trong đơn chất đồng vững chắc hơn.
7.81. Khi Cu phản ứng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
A. chất xúc tác.
B. chất oxi hoá.
C. chất khử.
D. môi trường.
7.82. Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là
A. CuCO3
B. CuSO4.
C. Cu(OH)2.
D. CuCO3.Cu(OH)2
7.83. Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm
dung dịch KOH dư rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
A. 1.
B. 2.
C.3
D. 4.
Hướng dẫn trả lời:
7.78. C
7.79. B
7.80. B
7.81. B
7.82. D
7.83. A
Bài 7.84, 7.85, 7.86 trang 86 sách bài tập (SBT) Hóa học 12
7.84*. Cho sơ đồ sau:
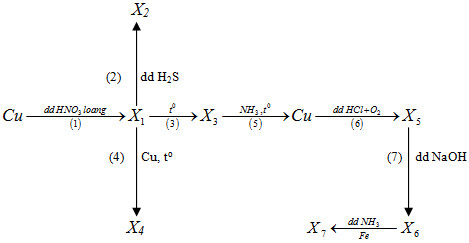
Biết các chất từ X1đến X7 đều là các hợp chất của đồng. Trong sơ đồ trên số phản ứng oxi hoá - khử là
A.4.
B. 5.
C. 6.
D.7
7.85. Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
A. 0,04.
B. 0,075.
C. 0,12.
D. 0,06.
7.86. Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu đươc dung dich A và 224 ml khí NO duy nhât (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
A. 0,1M.
B. 0,25M.
C.0,2M.
D. 0,5M.
Hướng dẫn trả lời:
7.84. D
7.85. C
7.86. Chọn C
Ta dùng phương trình bán phản ứng của HNO3:
![]() \(4HN{O_3} + 3{\rm{e}} \to NO + 3NO_3^ - + 2{H_2}O\)
\(4HN{O_3} + 3{\rm{e}} \to NO + 3NO_3^ - + 2{H_2}O\)
![]() \({n_{NO}} = 0,01\,mol \Rightarrow {n_{HN{O_3}}} = 0,04\,mol\)
\({n_{NO}} = 0,01\,mol \Rightarrow {n_{HN{O_3}}} = 0,04\,mol\)
![]() \(\Rightarrow {C_{M\left( {HN{O_3}} \right)}} = {{0,04} \over {0,2}} = 0,2M\)
\(\Rightarrow {C_{M\left( {HN{O_3}} \right)}} = {{0,04} \over {0,2}} = 0,2M\)
Bài 7.87 trang 86 sách bài tập (SBT) Hoá học 12
Nguyên tử đồng có 1 electron ở lớp ngoài cùng nhưng tại sao đồng có hoá trị II? Đồng tác dụng như thế nào với các axit?
Hướng dẫn trả lời:
– Do Cu có phân lớp d đầy đủ nhưng cấu trúc chưa hoàn toàn bền vững nên nguyên tử có thể bị kích thích chuyển thành trạng thái 3d94s2 nên ngoai hóa trị I Cu thường có hóa trị II khi kết hượp với các nguyên tử khác
- Khả năng Cu tác dụng với các axit
+ Cu không tác dụng với các axit không có tính oxi hóa như HCl, H2SO4 (l)
+ Cu tác dụng với các axit có tính oxi hóa như H2SO4(đ), HNO3,…
Cu + 2H2SO4 (đ) → CuSO4 + SO2 + 2H2O
3Cu + 8HNO3 (l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 (đ) → Cu(NO3)2 + 2NO2 + 2H2O
Bài 7.88 trang 86 sách bài tập (SBT) Hóa học 12
Bột đồng có lẫn tạp chất là bột thiếc, kẽm, chì. Hãy nêu phương pháp hoá học đơn giản để loại bỏ tạp chất. Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn.
Hướng dẫn trả lời:
Cho bột đồng lẫn tạp chất bột thiếc, kẽm, chì hòa tan vào dung dịch CuSO4 thì các tạp chất đều bị hòa tan còn lại bột đồng. Lọc tách ta được đồng nguyên chất
Các phản ứng xảy ra:
Zn + CuSO4 → ZnSO4 + Cu
Zn + Cu2+ → Zn 2+ + Cu
Sn + CuSO4 → SnSO4 + Cu
Sn + Cu2+ → Sn2+ + Cu
Pb + CuSO4 → PbSO4 +Cu
Pb + Cu2+ → Pb2+ + Cu.
Bài 7.89 trang 87 sách bài tập (SBT) Hóa học 12
Malachit có công thức hoá học là CuCO3.Cu(OH)2. Trình bày các phương pháp điều chế Cu từ chất này.
Hướng dẫn trả lời:
Cách 1:
![]() \(CuC{O_3}.Cu{(OH)_2}\buildrel {{t^0}} \over\longrightarrow 2CuO + C{O_2} + {H_2}O\)
\(CuC{O_3}.Cu{(OH)_2}\buildrel {{t^0}} \over\longrightarrow 2CuO + C{O_2} + {H_2}O\)![]() \(CuO + {H_2}\buildrel {{t^0}} \over\longrightarrow Cu + {H_2}O\)
\(CuO + {H_2}\buildrel {{t^0}} \over\longrightarrow Cu + {H_2}O\)
Cách 2:
![]() \(CuC{O_3}.Cu{(OH)_2} + 4HCl \to 2CuC{l_2} + C{O_2} + 3{H_2}O\)
\(CuC{O_3}.Cu{(OH)_2} + 4HCl \to 2CuC{l_2} + C{O_2} + 3{H_2}O\)![]() \(CuC{l_2}\buildrel {dp{\rm{dd}}} \over\longrightarrow Cu + C{l_2}\)
\(CuC{l_2}\buildrel {dp{\rm{dd}}} \over\longrightarrow Cu + C{l_2}\)
Bài 7.90 trang 87 sách bài tập (SBT) Hóa học 12
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau
- Cho phần (1) tác dụng với lượng dư dung dịch HC1, thu được 560 ml H2
- Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2.
Các thể tích khí đo ở đktc. Tính thành phần phần trăm khối lượng của từng kim loại trong hỗn hợp.
Hướng dẫn trả lời:
Phần 1:
![]() \(2Al + 6HCl \to 2AlC{l_3} + 3{H_2}(1)\)
\(2Al + 6HCl \to 2AlC{l_3} + 3{H_2}(1)\)
![]() \(Fe + 2HCl \to FeC{l_2} + {H_2}(2)\)
\(Fe + 2HCl \to FeC{l_2} + {H_2}(2)\)
Phần 2:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (3)
Từ pt (3): ![]() \({n_{Al}} = {2 \over 3}{n_{{H_2}}} = {2 \over 3}.{{0,336} \over {22,4}} = 0,01mol \to {m_{Al}} = 0,27g\)
\({n_{Al}} = {2 \over 3}{n_{{H_2}}} = {2 \over 3}.{{0,336} \over {22,4}} = 0,01mol \to {m_{Al}} = 0,27g\)
Theo (1), (2) và (3) ta có: V H2 (2) = 560-336 =224(ml)
Theo (2) ta có:
![]() \(\% {m_{Al}} = {{0,27} \over 2}.100 = 13,5\% ;{m_{Fe}} = {{0,56} \over 2}.100 = 28\%\)
\(\% {m_{Al}} = {{0,27} \over 2}.100 = 13,5\% ;{m_{Fe}} = {{0,56} \over 2}.100 = 28\%\)
![]() \({m_{Cu}} = 58,5\%\)
\({m_{Cu}} = 58,5\%\)
Bài 7.91 trang 87 sách bài tập (SBT) Hóa học 12
Thực hiện hai thí nghiệm:
1) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO31M thoát ra V 1 lít NO.
2) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1M và H2S04 0,5M thoát ra v2 lít NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Lập biểu thức biểu diễn mối quan hệ giữa V1 và V2.
Hướng dẫn trả lời:
Ta viết PTHH dạng ion rút gọn cho cả hai thí nghiệm như sau:
3Cu + 8H+ + 2NO3 ⟶ 3Cu2+ + 2NO + 4H2O
Thí nghiệm 1: ta có số mol các chất và ion: Cu : 0,06 mol; H+ : 0,08 mol; NO3- : 0,08 mol.
H+ phản ứng hết ⟹ VNO = V1 = ![]() \({{0,08} \over 4}\) .22,4 = 0,448 (lít) (1)
\({{0,08} \over 4}\) .22,4 = 0,448 (lít) (1)
Thí nghiệm 2: ta có số mol các'chất và ion: Cu : 0,06 mol; H+ : 0,16 mol; NO3- : 0,08 mol.
H+ và Cu phản ứng vừa đủ ⟹ VNO = V2 = ![]() \({{0,16} \over 4}\) .22,4 = 0,896 (lít) (2)
\({{0,16} \over 4}\) .22,4 = 0,896 (lít) (2)
Từ (1) và (2) ⟹ V2 = 2V1.
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


