Giải bài tập Hóa học 12 SBT bài 37
Hóa học 12 - Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
VnDoc xin giới thiệu tới các bạn tài liệu Giải bài tập Hóa học 12 SBT bài 37. Tài liệu đã được tổng hợp chi tiết và chính xác sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh giải Hóa 12 một cách hiệu quả nhất. Mời các bạn tham khảo.
Giải bài tập Hóa học 12 SBT bài 36
Giải bài tập Hóa học 12 bài 37: Luyện tập Tính chất hóa học của sắt và hợp chất của sắt
Giáo án Hóa học 12 bài 37: Luyện tập Tính chất hóa học của sắt và hợp chất của sắt
Giải bài tập Hóa học 12 sách bài tập
Bài 7.107, 7.108 trang 90 sách bài tập (SBT) Hóa học 12
7.107. Để bảo quản dung dịch FeSO4 trong phòng thí nghiêm, người ta ngâm vào dung dịch đó một đinh sắt đã làm sạch. Chọn cách giải thích đúng cho việc làm trên.
A. Để Fe tác dụng hết với H2SƠ4 dư khi điều chế FeSO4 bằng phản ứng:
Fe + H2SO4(loãng) → FeSO4 + H2↑
B. Để Fe tác dụng với các tạp chất trong dung dịch, chẳng hạn với tạp chất là CuSO4:
Fe + CuSO4 → FeSO4 + Cu
C. Để sắt tác dụng hết O2 hoà tan:
2Fe + O2 → 2FeO
D. Để sắt khử muối sắt(III) thành muối sắt(II):
Fe + Fe2(SO4)3 → 3FeSO4
7.108. Cho hai phương trình hoá học sau:
Cu + 2FeCl3 → 2FeCl2 + CuCl2 Fe + CuCl2 → FeCl2 + Cu
Có thể rút ra kết luận nào sau đây
A. Tính oxi hoá: Fe3+ > Cu2> Fe2+.
B. Tính oxi hoá: Fe2+ > Cu2+ > Fe3+.
C. Tính khử: Fe > Fe2+ > Cu.
D. Tính khử: Fe2+ > Fe > Cu.
Hướng dẫn trả lời:
7.107. D
7.108. A
Bài 7.109, 7.110, 7.111, 7.112 trang 91 sách bài tập (SBT) Hóa học 12
7.109. Nhúng thanh sắt (đã đánh sạch) vào các dung dịch ở ba thí nghiệm sau:
Thí nghiệm 1 : nhúng vào dung dịch CuSO4.
Thí nghiệm 2 :- nhúng vào dung dịch NaOH.
Thí nghiệm 3 : nhúng vào dung dịch Fe2(SO4)3.
Giả sử rằng các kim loại sinh ra (nếu có) đều bám vào thanh sắt thì nhận xét nào sau đây đúng?
A. Ở thí nghiệm 1, khối lượng thanh sắt giảm.
B. Ở thí nghiệm 2, khối lượng thanh sắt không đổi.
C. Ớ thí nghiệm 3, khối lượng thanh sắt không đổi.
D. A, B, C đều đúng.
7.110. Cho khí CO khử hoàn toàn 10 g quặng hematit. Lượng sắt thu được cho tác dụng hết với dung dịch H2SO4 loãng thu được 2,24 lít H2 (đktc). Phần trăm khối lượng của Fe2O3 trong quặng là
A. 70%.
B. 75%.
C. 80%.
D. 85%.
7.111. Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc, nóng (giả thiết
S02 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, thu được
A. 0,03 mol Fe2(SO4)3 và 0,06 mol FeSO4
B. 0,05 mol Fe2(SO4)3 0,02 mol Fe dư.
C. 0,02 mol Fe2(SO4)3 và 0,08 mol FeSO4.
D. 0,12 mol FeSO4.
7.112. Cho khí CO khử hoàn toàn đến Fe một hỗn hợp gồm: FeO, Fe2O3, Fe3O4 thấy có 4,48 lít CO2 (đktc) thoát ra. Thể tích CO (đktc) đã tham gia phản ứng là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn trả lời:
7.109. B
7.110. C
7.111. A
7.112. D
Dung dịch A có chứa CuSO4 và Fe2(SO4)3
a) Thêm Mg vào dung dịch A→ dung dịch B có 3 muối tan.
b) Thêm Mg vào dung dịch A → dung dịch C có 2 muối tan.
Viết PTHH của các phản ứng xảy ra.
Hướng dẫn trả lời:
a) Mg +Fe2(SO4)3 → MgSO4 + 2FeSO4 (1)
Mg + CuSO4→ MgS04 + Cu (2)
Dung dịch B có 3 muối là MgSO4, FeSO4 và CuSO4 dư.
b) Dung dịch C có 2 muối tan là MgSO4 và FeSO4.
7.110. Chọn C
![]() \(F{e_2}{O_3} + 3CO\buildrel {{t^0}} \over\longrightarrow 2Fe + 3C{O_2}\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
\(F{e_2}{O_3} + 3CO\buildrel {{t^0}} \over\longrightarrow 2Fe + 3C{O_2}\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
0,05 0,1(mol)
![]() \(Fe + {H_2}S{O_4}\)(loãng)
\(Fe + {H_2}S{O_4}\)(loãng)![]() \(\to FeS{O_4} + {H_2}\,\,\,\,\left( 2 \right)\)
\(\to FeS{O_4} + {H_2}\,\,\,\,\left( 2 \right)\)
0,1 ![]() \(\frac{2,24}{22,4}=0,1\) (mol)
\(\frac{2,24}{22,4}=0,1\) (mol)
Từ (1) và (2)
![]() \(\Rightarrow {n_{F{e_2}{O_3}}} = 0,05\,mol\)
\(\Rightarrow {n_{F{e_2}{O_3}}} = 0,05\,mol\)
![]() \(\% {m_{F{e_2}{O_3}}} = {{169.0,05} \over {10}}.100\% = 80\%\)
\(\% {m_{F{e_2}{O_3}}} = {{169.0,05} \over {10}}.100\% = 80\%\)
7.111. Chọn A
Sử dụng phương trình cho – nhận e và phương trình bán phản ứng ta có:
![]() \(Fe \to F{e^{3 + }} + 3e\)
\(Fe \to F{e^{3 + }} + 3e\)
![]() \(0,1 \leftarrow 0,1 \leftarrow 0,3\left( {mol} \right)\)
\(0,1 \leftarrow 0,1 \leftarrow 0,3\left( {mol} \right)\)
![]() \(2{H_2}S{O_4} + 2e \to S{O_4} + SO_4^{2 - } + 2{H_2}O\)
\(2{H_2}S{O_4} + 2e \to S{O_4} + SO_4^{2 - } + 2{H_2}O\)
0,3 − −−> 0,3(mol)
Fe dư: 0,02 mol
![]() \(Fe + 2F{e^{3 + }} \to 3F{e^{2 + }}\)
\(Fe + 2F{e^{3 + }} \to 3F{e^{2 + }}\)
![]() \(0,02 \to 0,04 \to 0,06\)
\(0,02 \to 0,04 \to 0,06\)
Vậy muối thu được gồm: ![]() \(\left| \matrix{FeS{O_4}:0,06\,mol \hfill \cr F{e_2}{\left( {S{O_4}} \right)_3}:0,03\,mol \hfill \cr} \right.\)
\(\left| \matrix{FeS{O_4}:0,06\,mol \hfill \cr F{e_2}{\left( {S{O_4}} \right)_3}:0,03\,mol \hfill \cr} \right.\)
7.112. Chọn D
Số mol CO phản ứng = số mol CO2 sinh ra
![]() \(\Rightarrow {V_{CO}} = {V_{C{O_2}}} = 4,48\) (lít)
\(\Rightarrow {V_{CO}} = {V_{C{O_2}}} = 4,48\) (lít)
Bài 7.113 trang 92 sách bài tập (SBT) Hóa học 12
Thực hiện những biến đổi hoá học trong sơ đồ sau bằng cách viết phương trình hoá học của các phản ứng và nêu điều kiện của phản ứng (nếu có).
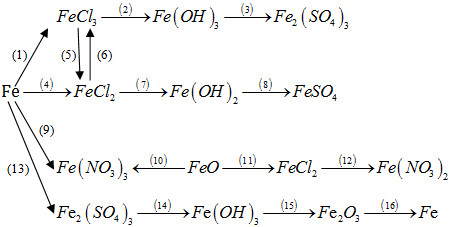
Hướng dẫn trả lời:
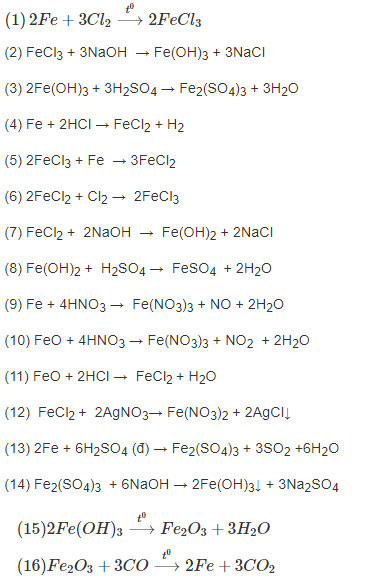
Bài 7.114 trang 92 sách bài tập (SBT) Hóa học 12
Dung dịch A có chứa CuSO4 và Fe2(SO4)3
a) Thêm Mg vào dung dịch A→ dung dịch B có 3 muối tan.
b) Thêm Mg vào dung dịch A → dung dịch C có 2 muối tan.
Viết PTHH của các phản ứng xảy ra.
Hướng dẫn trả lời:
a) Mg +Fe2(SO4)3 → MgSO4 + 2FeSO4 (1)
Mg + CuSO4→ MgS04 + Cu (2)
Dung dịch B có 3 muối là MgSO4, FeSO4 và CuSO4 dư.
b) Dung dịch C có 2 muối tan là MgSO4 và FeSO4.
Bài 7.115 trang 92 sách bài tập (SBT) Hóa học 12
Nhận biết từng oxit kim loại riêng biệt sau bằng phương pháp hoá học: CuO, Al2O3, FeO, Fe3O4, Fe2O3, CaO. Giải thích và viết phương trình hoá học của các phản ứng
Hướng dẫn trả lời:
Dùng H2O nhận biết CaO.
Dùng dung dịch HCl hoà tan các oxit được dung dịch muối clorua. Dung dịch nào có màu xanh thì oxit ban đầu là CuO. Dung dịch nào không màu tác dụng với NaOH tạo kết tủa keo tan trong NaOH dư thì oxit ban đầu là A12O3. Dung dịch màu lục nhạt tác dụng với NaOH tạo kết tủa trắng xanh chuyển dần-sang màu nâu đỏ thì oxit ban đầu là FeO.
Nhận biết Fe2O3 và Fe3O4 bằng dung dịch HNO3 loãng, phản ứng không giải phóng khí là Fe2O3, giải phóng khí hoá nâu trong không khí là Fe3O4.
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑+ 14H2O.
Bài 7.116 trang 92 sách bài tập (SBT) Hóa học 12
Muốn có đủ khí clo để tác dụng với 1,12 g Fe cần phải dùng bao nhiêu gam K2Cr2O7 và bao nhiêu mililít dung dịch HCl 36,5% (D = 1,19 g/ml)
Hướng dẫn trả lời:
n Fe= 1,12: 56= 0,04 mol
Các phản ứng xảy ra:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O (1)
2Fe + 3Cl2 → 2FeCl3 (2)
Theo pt (2) ta có: ![]() \({n_{C{l_2}}} = {3 \over 2}{n_{Fe}} = 0,03mol\)
\({n_{C{l_2}}} = {3 \over 2}{n_{Fe}} = 0,03mol\)
Theo pt (1) ta có:
![]() \({n_{HCl}} = {{14} \over 3}{n_{C{l_2}}} = {{14} \over 3}.0,03 = 0.14mol\)
\({n_{HCl}} = {{14} \over 3}{n_{C{l_2}}} = {{14} \over 3}.0,03 = 0.14mol\)
![]() \(\to {m_{{\rm{dd}}HCl}} = {{0,14.36,5.100} \over {36,5}} = 14g\)
\(\to {m_{{\rm{dd}}HCl}} = {{0,14.36,5.100} \over {36,5}} = 14g\)
![]() \(\to {V_{HCl}} = {{{m_{{\rm{dd}}HCl}}} \over d} = {{14} \over {1,19}} = 11,76ml\)
\(\to {V_{HCl}} = {{{m_{{\rm{dd}}HCl}}} \over d} = {{14} \over {1,19}} = 11,76ml\)
![]() \({n_{{K_2}C{r_2}{O_7}}} = {{{n_{C{l_2}}}} \over 3} = 0,01mol\)
\({n_{{K_2}C{r_2}{O_7}}} = {{{n_{C{l_2}}}} \over 3} = 0,01mol\)
![]() \(\to {m_{{K_2}C{r_2}{O_7}}} = 0,01.294 = 2,94g\)
\(\to {m_{{K_2}C{r_2}{O_7}}} = 0,01.294 = 2,94g\)
Bài 7.117 trang 92 sách bài tập (SBT) Hóa học 12
Hỗn hợp A gồm Fe và kim loại M có hoá trị không đổi trong mọi hợp chất, M đứng trước hiđro trong dãy điện hoá. Tỉ lệ số mol của M và Fe trong hỗn hợp A là 1 : 2. Cho 13,9 g hỗn hợp A tác dụng với khí Cl2 thì cần dùng 10,08 lít Cl2. Cho 13,9 g hỗn hợp A tác dụng với dung dịch HCl thì thu được 7,84 lít H2. Các thể tích khí đều đo ở đktc. Xác định kim loại M và % khối lượng của mỗi kim loại trong hỗn hợp A.
Hướng dẫn trả lời:
2M + 2nHCl → MCln + n H2
x 0,5nx(mol)
Fe + 2HCl → FeCl2 + H2
2x 2x (mol)
![]() \(0,5nx + 2x = {{7,84} \over {22,4}} = 0,35\)(1)
\(0,5nx + 2x = {{7,84} \over {22,4}} = 0,35\)(1)
2M + nCl2 → 2MCln
x 0,5nx(mol)
2Fe + 3Cl2 → 2FeCl3
2x 3x (mol)
![]() \(0,5nx + 3x = {{10,08} \over {22,4}} = 0,45(2)\)
\(0,5nx + 3x = {{10,08} \over {22,4}} = 0,45(2)\)
Từ (1) và (2) → n= 3, x= 0,1
mFe= 2.0,1.56= 11,2 g ; m M= 13,9-11,2= 2,7g
→M M= 2,7:0,1=27 → M là Al
![]() \(\to \% {m_{Al}} = {{2,7} \over {13,9}}.100 = 19,42\%\)
\(\to \% {m_{Al}} = {{2,7} \over {13,9}}.100 = 19,42\%\)
![]() \(\% {m_{Fe}} = 80,58\%\)
\(\% {m_{Fe}} = 80,58\%\)
Bài 7.118 trang 92 sách bài tập (SBT) Hóa học 12
Cho luồng khí co dư đi qua ống sứ đựng m gam hỗn hợp FeO và Fe2O3 nung nóng. Sau khi kết thúc phản ứng, khối lượng chất rắn trong ống sứ là 5,5 gam. Cho khí đi ra khỏi ống sứ hấp thụ vào nước vôi trong dư thấy có 5 gam kết tủa. Xác định giá trị của m.
Hướng dẫn trả lời:
Ta có sơ đồ phản ứng:
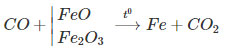
Nhận thấy, cứ 1 mol CO phản ứng sinh ra 1 mol CO2 thì khối lượng chất rắn giảm 16 gam
Mặt khác ta có: n CO2 =nCaCO3 =0,05 mol ⟹ khối lượng rắn giảm = 0,05.16 = 0,8 (gam)
⟹ khối lượng hỗn hợp oxit sắt ban đầu là: m = 5,5 + 0,8 = 6,3 (gam).
Bài 7.119 trang 93 sách bài tập (SBT) Hóa học 12
Cho 18,5 gam hỗn hợp X gồm Fe, Fe304 tác dụng với 200 ml dung dịch HNO3 loãng đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và còn lại 1,46 gam kim loại. Xác định khối lượng muối trong Y và nồng độ mol của dung dịch HNO3.
Hướng dẫn trả lời:
Sau phản ứng kim loại còn dư, vậy Fe chỉ bị oxi hoá lên Fe2+
Gọi x, y là số mol Fe và Fe3O4 phản ứng, khối lượng rắn phản ứng là
18,5- 1,46= 17,04 (gam).
⟹ 56x + 232y = 17,04 gam (1)
Ta có phương trình cho - nhận e:
Fe → Fe2+ + 2e Fe304 + 2e → 3Fe +2
x → x → 2x mol y → 2 y → 3y (mol)
N+5+ 3e → N+2
0,3 ← 0,1 (mol)
Áp dụng ĐLBTĐT, ta có: 2x = 2y + 0,3 (2)
Từ (1) và (2), giải hệ ta có: x = 0,18; y = 0,03
Vậy muối thu được là Fe(NO3)2: (x + 3y) = 0,27 mol ⟹ m = 48,6 g
Số mol HNO3 phản ứng = 2.nFe(NO3 )2 +nN0 = 2.0,27 + 0,1 = 0,64 mol
⟹ CM(HNO3) = 3,2 (M).
Bài 7.120 trang 93 sách bài tập (SBT) Hóa học12
Hoà tan hoàn toàn 10 gam hỗn hợp X (Fe, Fe2O3) trong dung dịch HNO3 vừa đủ được 1,12 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho Y tác dụng với NaOH dư được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được m gam chất rắn. Xác định giá trị của m.
Hướng dẫn trả lời:
Ta có sơ đồ phản ứng:
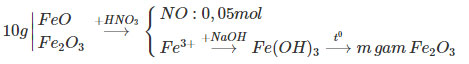
Vì chỉ có Fe phản ứng sinh ra khí NO, sử dụng phương trình cho - nhận e
⟹ nFe =nNO =0,05-mol.
m Fe ban đầu =0,05.56 = 2,8(gam) ⟹ m Fe2O3 sau = 160.0,025 = 4(gam)
ban đầu = 10 - 2,8 = 7,2 (gam)
Vậy m = 4 + 7,2 =11,2 (gam).
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


