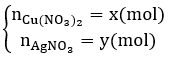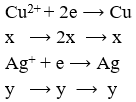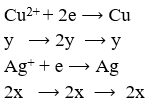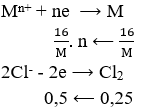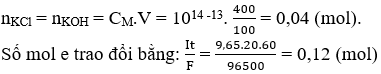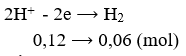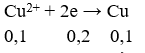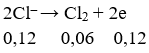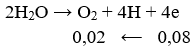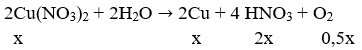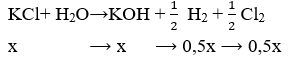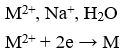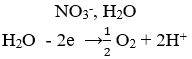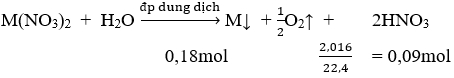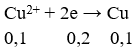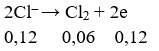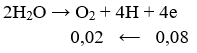Điện phân hoàn toàn 200 ml một dung dịch chứa 2 muối là Cu(NO3)2 và AgNO3 với I = 0,804A, thời gian điện phân là 2 giờ, người ta nhận thấy khối lượng cực âm tăng thêm 3,44 g. Nồng độ mol của mỗi muối trong dung dịch ban đầu lần lượt là:
Trắc nghiệm Đại cương về kim loại Hóa học 12 (Nâng cao - Phần 4)
Trắc nghiệm chương Đại cương về kim loại
Nhằm hỗ trợ học sinh làm quen các câu hỏi trắc nghiệm Hóa 12 nâng cao khác nhau, VnDoc mang đến cho các bạn tài liệu Trắc nghiệm Đại cương về kim loại Hóa học 12 (Nâng cao - Phần 4) kèm đáp án chi tiết.
- Trắc nghiệm Đại cương về kim loại Hóa học 12 (Nâng cao - Phần 3)
- Trắc nghiệm Đại cương về kim loại Hóa học 12 (Nâng cao - Phần 5)
- 1
- 2
Điện phân dung dịch hỗn hợp chứa Ag2SO4 và CuSO4 một thời gian thấy khối lượng catot tăng lên 4,96g và khí thoát ra ở anot có thể tích là 0,336 lít (đktc). Khối lượng kim loại bám ở catot lần lượt là:
- 3
Điện phân một dung dịch muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
- 4
Có 400ml dung dịch chứa HCl và KCl đem điện phân trong bình điện phân có vách ngăn với cường độ dòng điện 9,65A trong 20 phút thì dung dịch chứa một chất tan có pH = 13 (coi thể tích dung dịch không đổi). Nồng độ mol/lit của HCl và KCl trong dung dịch ban đầu lần lượt bằng:
- 5
Điện phân 100ml dung dịch A chứa Cu2+, Na+; H+; SO42- có pH = 1, điện cực trơ. Sau một thời gian điện phân, rút điện cực ra khỏi dung dịch, thấy khối lượng dung dịch giảm 0,64 gam và dung dịch có màu xanh nhạt, thể tích dung dịch không đổi. Tính nồng độ H+ có trong dung dịch sau khi điện phân.
- 6
Điện phân dung dịch chứa a mol CuSO4 và b mol NaCl (với điện cực trơ, có màng ngăn xốp). Để dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng thì điều kiện của a và b là (biết ion SO42- không bị điện phân trong dung dịch)
- 7
Mắc nối tiếp hai bình điện phân: bình (1) chứa dung dịch MCl2 và bình (2) chứa dung dịch AgNO3. Sau 3 phút 13 giây thì ở catot bình (1) thu được 1,6 gam kim loại còn ở catot bình (2) thu được 5,4 gam kim loại. Cả hai bình đều không thấy khí ở catot thoát ra. Kim loại M là:
- 8
Hòa tan 50 gam tinh thể CuSO4.5H2O vào 200 ml dung dịch HCl 0,6 M thu được dung dịch X. Đem điện phân dung dịch X (các điện cực trơ) với cường độ dòng điện 1,34A trong 4 giờ. Khối lượng kim loại thoát ra ở catot và thể tích khí thoát ra ở anot (ở đktc) lần lượt là (Biết hiệu suất điện phân là 100 %):
- 9
Điện phân dung dịch Cu(NO3)2 với cường độ dòng điện 9,65A đến khi bắt đầu có khí thoát ra ở catot thì dừng lại. thời gian điện phân là 40 phút. Khối lượng Cu sinh ra ở catot là:
- 10
Điện phân dung dịch gồm 7,45 gam KCl và 28,2 gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm đi 10,75 gam thì ngừng điện phân (giả thiết lượng nước bay hơi không đáng kể). Tất cả các chất tan trong dung dịch sau điện phân là
- 11
Điện phân dung dịch hỗn hợp chứa 18,8g Cu(NO3)2 và 29,8g KCl điện cực trơ có màng ngăn. Sau một thời gian thấy khối lượng dung dịch giảm 17,15g so với ban đầu, thể tích dung dịch là 400ml. Nồng độ mol lớn nhất của các chất sau điện phân là giá trị nào dưới đây?
- 12
Điện phân dung dịch A chứa 0,4 mol M(NO3)2 và 1 mol NaNO3 với điện cực trơ trong thời gian 48 phút 15 giây thì thu được 11,52 gam kim loại M bên catot. Cho các phát biểu sau:
1. M là Cu.
2. Cường độ dòng điện đã dùng bằng 10 (A).
3. Thời gian điện phân dung dịch mất hết M2+ với cường độ dòng điện 12 (A) là là 48 phút 15 giây.
Trong các phát biểu trên, số phát biểu đúng là?
- 13
Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
- 14
Hòa tan 50 gam tinh thể CuSO4.5H2O vào 200 ml dung dịch HCl 0,6 M thu được dung dịch X. Đem điện phân dung dịch X (các điện cực trơ) với cường độ dòng điện 1,34A trong 4 giờ. Khối lượng kim loại thoát ra ở catot và thể tích khí thoát ra ở anot (ở đktc) lần lượt là (Biết hiệu suất điện phân là 100 %):
- 15
Ngâm 1 lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất mạnh và nhanh. Chất tan trong dung dịch X là