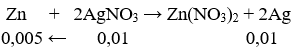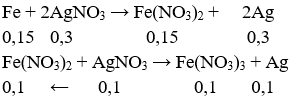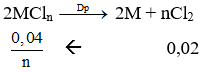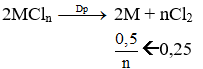Ngâm một lá kẽm trong 100ml dung dịch AgNO3 0,1 mol. Kết thúc phản ứng, khối lượng lá kẽm là bao nhiêu?
Trắc nghiệm Đại cương về kim loại Hóa học 12 (Phần 2)
Trắc nghiệm chương Đại cương về kim loại
VnDoc mời các bạn cùng tham khảo bài Trắc nghiệm Đại cương về kim loại Hóa học 12 (Phần 2) kèm theo lời giải chi tiết, hỗ trợ học sinh ôn luyện nâng cao kết quả học tập môn Hóa 12.
- 1
- 2
Cho 8,4 g Fe vào dung dịch có chứa 0,4mol AgNO3. Kết thúc phản ứng, khối lượng bạc là bao nhiêu?
- 3
Cho biết các cặp oxi hoá - khử sau: Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+
Tính oxi hoá tăng dần theo thứ tự
- 4
Muốn khử dd chứa Fe3+ thành dd có chứa Fe2+ cần dùng kim loại sau:
- 5
Cho các kim loại: Fe, Al, Mg, Cu, Zn, Ag. Số kim loại tác dụng được với dd H2SO4 loãng là:
- 6
Ngâm Cu dư vào dd AgNO3 thu được dd X, sau đó ngâm Fe dư vào dung dịch X thu được dung dịch Y, dung dịch Y gồm:
- 7
Ngâm đinh sắt sạch trong 200 ml dd CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 8 gam. Nồng độ CuSO4 ban đầu là:
- 8
Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau khi điện phân cho ra một dung dịch axit (điện cực trơ)
- 9
Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là:
- 10Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
- 11
Trong quá trình điện phân, các muối X- (X: Cl-, Br-) di chuyển về:
- 12
Cho dung dịch chứa các ion: Na+, K+, Cu+, Cl-, SO42-, NO32-. Các ion nào không bị điện phân khi ở trạng thái dung dịch:
- 13
Điện phân một lượng dư dung dịch MgCl2 (điện cực trơ, có màng ngăn xốp bao điện cực) với cường độ dòng điện 2,68A trong 2 giờ. Sau khi dừng điện phân khối lượng dung dịch giảm m gam, giả thiết nước không bay hơi, các chất tách ra đều khan. Giá trị của m là:
- 14
Điện phân nóng chảy hoàn toàn 1,9g muối clorua của kim loại M được 0,48g kim loại M ở catot. Kim loại M là:
- 15
Điện phân một dd muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là: