Đề khảo sát lớp 10 môn Hóa học năm 2015 trường THPT Chuyên Hùng Vương
Đề khảo sát lớp 10 môn Hóa học năm 2015 trường THPT Chuyên Hùng Vương là đề thi khảo sát chất lượng môn hóa trường chuyên hữu ích. Tài liệu này bao gồm đề thi và lời giải chi tiết, giúp các bạn có thể tự luyện tập và kiểm tra lại dễ dàng hơn. Mời các bạn cùng tham khảo.
Đề thi khảo sát lớp 10 môn Hóa
|
TRƯỜNG THPT
|
ĐỀ KHẢO SÁT |
Mã đề thi 132
Họ, tên thí sinh:..........................................................................
Số báo danh:...............................................................................
ĐỀ THI GỒM 50 CÂU (TỪ CÂU 1 ĐẾN CÂU 50) DÀNH CHO TẤT CẢ CÁC THÍ SINH.
Cho nguyên tử khối của các nguyên tố: H = 1; O = 16; F = 19; Cl = 35,5; Br = 80; I = 127; S = 32; Na = 23; K = 39; Li = 7; Ba = 137; Ca = 40; Mg = 24; Al = 27; Fe = 56; Ag = 108.
Câu 1: Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O (b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O (d) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 4. B. 3. C. 2. D. 1.
Câu 2: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p43s1. B. 1s22s22p63s1. C. 1s22s22p53s2. D. 1s22s22p63s2.
Câu 3: Nguyên tố Y là phi kim thuộc chu kì 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là
A. Fe. B. Zn. C. Cu. D. Mg.
Câu 4: Để điều chế 3,36 lít khí Cl2 (đktc) từ các chất NaCl, H2SO4, MnO2 thì cần m gam NaCl. Hiệu suất phản ứng là 100%. Giá trị của m là
A. 36,10. B. 17,55. C. 8,77. D. 37,50.
Câu 5: X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
A. Độ âm điện của X lớn hơn độ âm điện của Y.
B. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
C. Đơn chất X là chất khí ở điều kiện thường.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
Câu 6: Hoà tan hết 2,8 gam kim loại M trong 200 ml dung dịch HCl 1M, thu được 4,48 lít khí (đktc). M là
A. Na. B. Ca. C. K. D. Li.
Câu 7: Trong số những câu sau đây, câu nào sai?
A. Trong một chu kì, theo chiều điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần.
B. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
C. Bảng tuần hoàn các nguyên tố hóa học có 7 chu kì, chu kì 1, 2, 3 là các chu kì nhỏ, chu kì 4, 5, 6, 7 là các chu kì lớn.
D. Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhau.
Câu 8: Trong nguyên tử X, giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3 cm. Tính khối lượng riêng (tấn/cm3) của hạt nhân nguyên tử X.
A. 117,5.1012. B. 117,5.106. C. 116.1012. D. 116.106.
Câu 9: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
A. 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O B. NaOH + HCl → NaCl + H2O
C. CaO + CO2 → CaCO3 D. AgNO3 + HCl → AgCl + HNO3
Câu 10: Các khí có thể cùng tồn tại trong một hỗn hợp là
A. H2S và Cl2. B. HI và O3. C. Cl2 và O2. D. NH3 và HCl.
Câu 11: Cho FeS tác dụng với dung dịch HCl thu được khí X. Nhiệt phân KClO3 có xúc tác MnO2 thu được khí Y. Cho Na2SO3 tác dụng với dung dịch HCl thu được khí Z. Các khí X, Y, Z lần lượt là
A. H2S, Cl2, SO2. B. O2, H2S, SO2. C. H2S, O2, SO2. D. O2, SO2, H2S.
Câu 12: Cho phương trình hóa học (với a, b, c, d là các hệ số):
aFeSO4 + bCl2 → cFe2(SO4)3 + dFeCl3
Tỉ lệ a : c là:
A. 4 : 1. B. 3 : 2. C. 2 : 1. D. 3 :1.
Câu 13: Một nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52 và có số khối là 35. Số hiệu nguyên tử của nguyên tố X là:
A. 17. B. 15. C. 23. D. 18.
Câu 14: Hòa tan hoàn toàn 2,84 gam hỗn hợp hai muối cacbonat của hai kim loại nhóm IIA và thuộc hai chu kỳ liên tiếp trong bảng tuần hoàn bằng dung dịch HCl, thu được dung dịch X và 672 ml CO2 (đktc). Hai kim loại là:
A. Be, Mg. B. Mg, Ca. C. Ca, Ba. D. Ca, Sr.
Câu 15: Hạt nhân nguyên tử R có điện tích bằng 20+. Nguyên tố R ở vị trí nào trong bảng tuần hoàn ?
A. Chu kì 3, nhóm IIA. B. Chu kì 3, nhóm IIB. C. Chu kì 4, nhóm IIA. D. Chu kì 4, nhóm IIIA.
Câu 16: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
A. 2. B. 4. C. 3. D. 5.
Câu 17: Mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là :
A. HI, HBr, HCl. B. HI, HCl, HBr. C. HBr, HI, HCl. D. HCl, HBr, HI.
Câu 18: Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (). Phát biểu nào sau đây đúng?
A. Ở nhiệt độ thường X không khử được.
B. Kim loại X không khử được ion trong dung dịch.
C. Hợp chất với oxi của X có dạng.
D. Trong nguyên tử nguyên tố X có 25 proton.
Câu 19: Mg có 3 đồng vị 24Mg, 25Mg và 26Mg. Clo có 2 đồng vị 35Cl và 37Cl. Có bao nhiêu loại phân tử MgCl2 khác tạo nên từ các đồng vị của 2 nguyên tố đó?
A. 6. B. 12. C. 10. D. 9.
Câu 20: Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A. nhường 12 electron. B. nhận 12 electron. C. nhường 13 electron. D. nhận 13 electron.
Câu 21: Hoà tan hoàn toàn 4,78 gam hỗn hợp muối cacbonat của 2 kim loại kiềm và một kim loại kiềm thổ vào dung dịch HCl, thấy thoát ra V lít khí (đktc). Dung dịch thu được đem cô cạn thu được 5,33 gam muối khan. Giá trị của V là:
A. 3,36 lít. B. 1,68 lít. C. 2,24 lít. D. 1,12 lít.
Câu 22: Cho dãy gồm các phân tử và ion: Zn, S, FeO, SO2, Fe2+, Cu2+, HCl. Tổng số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
A. 6. B. 4. C. 7. D. 5.
Câu 23: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là:
A. Al. B. Zn. C. BaCO3. D. giấy quỳ tím.
Câu 24: Phát biểu nào dưới đây không đúng?
A. Vỏ nguyên tử được cấu thành bởi các hạt electron.
B. Hạt nhân nguyên tử được cấu thành từ các hạt proton và nơtron.
C. Với mọi nguyên tử, khối lượng nguyên tử bằng số khối.
D. Nguyên tử được cấu thành từ các hạt cơ bản là proton, nơtron và electron.
Câu 25: Cho phản ứng : FeSO 4 + K 2 Cr 2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H 2 O
Tổng hệ số cân bằng của các chất trong phản ứng là:
A. 14. B. 30. C. 26. D. 12
Câu 26: Ở trạng thái cơ bản:
- Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1.
- Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7.
- Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt.
Nhận xét nào sau đây là sai?
A. Độ âm điện giảm dần theo thứ tự X, Y, Z. B. Số oxi hóa cao nhất của X trong hợp chất là +7.
C. Oxit và hiđroxit của Y có tính lưỡng tính. D. Nguyên tố X và Y thuộc 2 chu kì kế tiếp.
Câu 27: Chất nào sau đây là hợp chất ion?
A. CO2. B. HCl. C. SO2. D. K2O.
Câu 28: X là hợp kim của kim loại kiềm M (nhóm IA) và kim loại kiềm thổ R (nhóm IIA). Lấy 28,8 gam X hòa tan hoàn toàn vào nước, thu được 6,72 lít H2 (đktc). Đem 2,8 gam Li luyện thêm vào 28,8 gam X, thu được hợp kim Y chứa 13,29% Li về khối lượng. Kim loại kiềm thổ R trong hợp kim X là:
A. Ba. B. Ca. C. Sr. D. Mg.
Câu 29: Tính chất axit của dãy các hiđroxit: H2SiO3, H2SO4, HClO4 biến đổi nh ư thế nào?
A. Tăng. B. Không tuân theo quy luật.
C. Giảm. D. Không thay đổi.
Câu 30: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
A. 5. B. 7. C. 6. D. 8.
Câu 31: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(e) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu đúng là
A. 2. B. 4. C. 3. D. 5.
Câu 32: X, Y, Z là những nguyên tố có số đơn vị điện tích hạt nhân lần lượt là 9, 19, 8. Nếu các cặp X và Y; Y và Z; X và Z tạo thành liên kết hoá học thì các cặp nào sau đây có liên kết cộng hoá trị phân cực?
A. Cặp X và Z. B. Cặp X và Y, cặp X và Z.
C. Cặp X và Y, cặp Y và Z. D. Cả 3 cặp.
Câu 33: Khí nào sau đây không bị oxi hóa bởi nước Gia-ven.
A. HCHO. B. H2S. C. CO2. D. SO2.
Câu 34: Cho dung dịch chứa 8,04 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 11,48 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 58,2%. B. 47,2%. C. 41,8%. D. 52,8%.
Câu 35: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là:
A. kim loại và khí hiếm. B. phi kim và kim loại. C. kim loại và kim loại. D. khí hiếm và kim loại.
Câu 36: Cho dung dịch AgNO3 dư tác dụng với dung dịch hỗn hợp có hòa tan 6,25 gam hai muối KCl và KBr (dung dịch X), thu được 10,39 gam hỗn hợp AgCl và AgBr. Tổng số mol các chất tan trong X là:
A. 0,08 mol. B. 0,06 mol. C. 0,03 mol. D. 0,055 mol.
Câu 37: Có các nhận định
(1) S2- < Cl- < Ar < K+ là dãy được sắp xếp theo chiều tăng dần bán kính nguyên tử.
(2) Có 3 nguyên tố mà nguyên tử của nó ở trạng thái cơ bản có cấu hình electron ở lớp vỏ ngoài cùng là 4s1.
(3) Cacbon có hai đồng vị, Oxi có 3 đồng vị. Số phân tử CO2 được tạo ra từ các đồng vị trên là 12.
(4) Các nguyên tố: F, O, S, Cl đều là những nguyên tố p.
(5) Nguyên tố X tạo được hợp chất khí với hiđro có dạng HX. Vậy X tạo được oxit cao X2O7.
Số nhận định không chính xác là :
A. 5. B. 2. C. 4. D. 3.
Câu 38: Muối T tạo bởi kim loại M (hoá trị II) và phi kim X (hoá trị I). Hoà tan một lượng T vào nước, thu được dung dịch Y. Nếu thêm AgNO3 dư vào Y thì khối lượng kết tủa tách ra bằng 188% khối lượng T. Nếu thêm Na2CO3 dư vào dung dịch Y thì khối lượng kết tủa tách ra bằng 50% khối lượng T. Công thức của muối T là
A. CaBr2. B. CaCl2. C. BaBr2. D. BaCl2.
Câu 39: Cho dung dịch AgNO3 vào 4 ống nghiệm chứa dung dịch NaF, NaCl, NaBr, NaI.
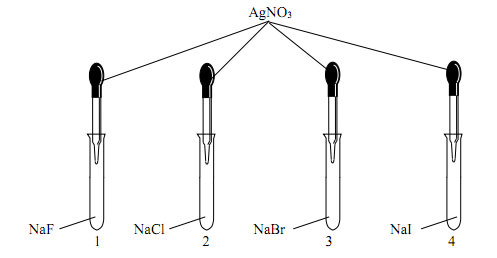
Hiện tượng xảy ra trong các ống nghiệm 1, 2, 3, 4 lần lượt là:
A. Không có hiện tượng, có kết tủa trắng, có kết tủa trắng, không có hiện tượng.
B. Có kết tủa trắng, có kết tủa vàng, có kết tủa vàng đậm, không có hiện tượng.
C. Không có hiện tượng, có kết tủa trắng, có kết tủa vàng đậm, có kết tủa vàng.
D. Không có hiện tượng, có kết tủa trắng, có kết tủa vàng, có kết tủa vàng đậm.
Câu 40: Sau khi đun nóng 23,7 gam KMnO4, thu được 22,74 gam hỗn hợp chất rắn. Cho hỗn hợp chất rắn trên tác dụng hoàn toàn với dung dịch axit HCl 36,5% (d = 1,18 g/ml) đun nóng. Thể tích khí Cl2 (đktc) thu được là:
A. 7,056. B. 2,24. C. 3,36. D. 4,48.
Câu 41: Trong một nhóm A (phân nhóm chính), trừ nhóm VIIIA (phân nhóm chính nhóm VIII), theo chiều tăng của điện tích hạt nhân nguyên tử thì
A. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
B. tính kim loại tăng dần, bán kính nguyên tử giảm dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, độ âm điện tăng dần.
Câu 42: Cho hình vẽ mô tả thí nghiệm:
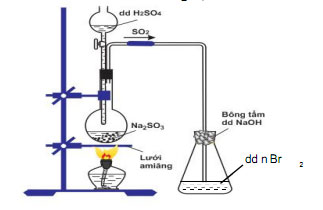
Hiện tượng xảy ra trong bình eclen (bình tam giác) chứa Br2:
A. Có kết tủa xuất hiện. B. Dung dịch Br2 bị mất màu.
C. Vừa có kết tủa vừa mất màu dung dịch Br2. D. Dung dịch Br2 không bị mất màu.
Câu 43: Trộn 5,6 gam bột sắt với 3,2 gam bột lưu huỳnh rồi nung nóng trong điều kiện không có không khí, thu được hỗn hợp rắn Y. Cho Y tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí Z và còn lại một phần không tan G. Để đốt cháy hoàn toàn Z và G cần vừa đủ V lít O2 (ở đktc). Giá trị của V là:
A. 3,36. B. 4,48. C. 3,08. D. 2,8.
Câu 44: Oxit cao nhất của nguyên tố R ứng với công thức RO2. Trong hợp chất khí của nó với hiđro, R chiếm 75% về khối lượng. Khẳng định nào sau đây là sai?
A. Liên kết hóa học giữa các nguyên tử trong phân tử RO2 là liên kết cộng hóa trị có cực.
B. Độ âm điện của nguyên tử nguyên tố R lớn hơn độ âm điện của nguyên tử nguyên tố hiđro.
C. Lớp ngoài cùng của nguyên tử R (ở trạng thái cơ bản) có 4 electron.
D. Phân tử RO2 là phân tử phân cực.
Câu 45: Hòa tan hoàn toàn 6,94 gam hỗn hợp FexOy và Al trong 100 ml dung dịch H2SO4 1,8M, thu được 0,672 lít H2 (đktc). Biết lượng axit đã lấy dư 20% so với lượng cần thiết để phản ứng (giả sử không có phản ứng khử Fe3+ thành Fe2+). Công thức của FexOy là
A. FeO. B. Fe3O4 hoặc FeO. C. Fe3O4. D. Fe2O3.
Câu 46: Cho 24,8 gam hỗn hợp X gồm kim loại kiềm thổ M và oxit của nó tác dụng với HCl dư, thu được 55,5 gam muối khan và 4,48 lít khí H2 (ở đktc). Kim loại M là
A. Sr. B. Ba. C. Ca. D. Mg.
Câu 47: Khi cho a gam dung dịch H2SO4 nồng độ C% tác dụng với lượng dư hỗn hợp Na, Mg thì khối lượng khí H2 (khí duy nhất) thoát ra bằng 4,5% khối lượng dung dịch axit đã dùng. C% của dung dịch H2SO4 là:
A. 15%. B. 45%. C. 30%. D. 25%.
Câu 48: Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành 2 nguyên tố trên có dạng là :
A. X3Y2. B. X5Y2. C. X2Y5. D. X2Y3.
Câu 49: Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
A. K, Mg, N, Si. B. N, Si, Mg, K. C. K, Mg, Si, N. D. Mg, K, Si, N.
Câu 50: Cho phản ứng: NaX (rắn) + H2SO4 (đặc) → NaHSO4 + HX (khí)
Các hiđro halogenua (HX) có thể điều chế theo phản ứng trên là
A. HCl, HBr và HI. B. HF và HCl. C. HBr và HI. D. HF, HCl, HBr và HI.
Đáp án đề thi khảo sát lớp 10 môn Hóa
|
1C |
2B |
3A |
4B |
5D |
6D |
7D |
8B |
9A |
10C |
|
11C |
12D |
14A |
14B |
15C |
16A |
17D |
18B |
19D |
20C |
|
21D |
22D |
23C |
24C |
25C |
26B |
27D |
28A |
29A |
30C |
|
31B |
32A |
33C |
34C |
35B |
36B |
37B |
38A |
39D |
40A |
|
41A |
42B |
43A |
44D |
45D |
46C |
47C |
48A |
49C |
50B |


