Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Thực hành Cao Nguyên, Đăk Lăk (Lần 3)
Đề thi thử THPT Quốc gia 2017 môn Hóa học
VnDoc mời bạn tham khảo: Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Thực hành Cao Nguyên, Đăk Lăk (Lần 3). Thông qua việc giải đề thi để các bạn củng cố lại kiến thức môn học, tích lũy kiến thức và nâng cao kỹ năng giải đề, biết cách phân bổ thời gian hợp lý trong từng bài thi. Chúc các bạn hoàn thành tốt kì thi!
|
TRƯỜNG ĐẠI HỌC TÂY NGUYÊN ĐỀ THI CHÍNH THỨC |
ĐỀ THI THỬ THPT QUỐC GIA 2017 (LẦN 3) (Đề thi có 04 trang-40 câu trắc nghiệm) |
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137. P = 31; Mn = 55;
Câu 41: Cho dãy các chất: phenyl axetat, anlyl axetat, metyl axetat, etyl fomat, tripanmitin. Số chất trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol là
A. 4. B. 2. C. 5. D. 3.
Câu 42: Thủyphân m gam saccarozơ trongmôi trường axit với hiệusuất 90% thu được sản phẩm chứa 10,8gam glucozo. Giátrị của m là
A. 22,8 B. 18,5 C. 17,1 D. 20,5
Câu 43: Phát biểu nào sau đây đúng
A. Các amin đều không độc, được sử dụng trong chế biến thực phẩm
B. Ở nhiệt độ thường, tất cả các amin đều tan nhiều trong nước.
C. Tất cả các amin đều làm quỳ tím ẩm chuyển màu xanh.
D. Để rửa sạch ống nghiệm có dính anilin, có thể dùng dung dịch HCl.
Câu 44: Khối lượng K2O cần lấy để hoà tan vào 70,6g nước để thu được dung dịch có nồng độ 14% là
A. 4,9g. B. 4,8g. C. 8,4g. D. 9,4g.
Câu 45: Triolein không tác dụng với chất (hoặc dung dịch) nào sau đây
A. Cu(OH)2 (ở điều kiện thường). B. Dung dịch NaOH (đun nóng).
C. H2O (xúc tác H2SO4 loãng, đun nóng). D. H2 (xúc tác Ni, đun nóng).
Câu 46: Khi nói về peptit và protein, phát biểu nào sau đây là sai?
A. Liên kết của nhóm CO với nhóm NH giữa hai đơn vị α-amino axit được gọi là liên kết peptit.
B. Thủy phân hoàn toàn protein đơn giản thu được các α -amino axit.
C. Tất cả các protein đều tan trong nước tạo thành dung dịch keo.
D. Protein có phản ứng màu biure với Cu(OH)2.
Câu 47: Trong các polime: tơ tằm, sợi bông, tơ visco, tơ nilon-6, tơ nitron, những polime có nguồn gốc từ xenlulozơ là
A. sợi bông, tơ visco và tơ nilon-6. B. tơ tằm, sợi bông và tơ nitron.
C. sợi bông và tơ visco. D. tơ visco và tơ nilon-6.
Câu 48: Cacbohiđrat nhất thiết phải chứa nhóm chức của
A. ancol. B. anđehit. C. xeton. D. amin.
Câu 49: Cho một thanh sắt nhỏ vào dung dịch chứa một trong các muối sau: AlCl3, CuSO4, MgCl2, KNO3, AgNO3. Sau một thời gian lấy thanh sắt ra khỏi dung dịch muối, khối lượng thanh sắt tăng. Các muối đó là
A. AlCl3, CuSO4 B. CuSO4, MgCl2 C. KNO3, AgNO3 D. Cu(NO3)2, AgNO3
Câu 50: Cho a mol bột kẽm vào dung dịch có hòa tan b mol Fe(NO3)3. Điều kiện liên hệ giữa a và b để sau khi kết thúc phản ứng không có kim loại là
A. a ≥ 2b B. b = 2a/3 C. b ≥ 2a D. b > 3a
Câu 51: Tính chất không phải của kim loại kiềm là
A. Có nhiệt độ nchảy thấp nhất trong tất cả kim loại.
B. Có số oxi hoá +1 trong các hợp chất.
C. Kim loại kiềm có tính khử mạnh.
D. Độ cứng cao.
Câu 52: Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại
A. Cu. B. Zn. C. Sn. D. Pb.
Câu 53: Để đánh giá sự ô nhiễm kim loại nặng trong nước thải của một nhà máy, người ta lấy một ít nước, cô đặc rồi thêm dung dịch Na2S vào thấy xuất hiện kết tủa màu vàng. Hiện tượng trên chứng tỏ nước thải bị ô nhiễm bởi ion
A. Cu2+
B. Cd2+
C. Pb2+
D. Fe2+
Câu 54: Điện phân muối clorua kim loại kiềm nóng chảy thu được 0,04 mol khí ở anot và 3,12 gam kim loại ở catot. Công thức phân tử của muối kim loại kiềm là
A. KCl. B. NaCl. C. LiCl. D. RbCl.
Câu 55: Xét về tính chất vật lý, so với nhôm thì sắt:
A. có tính nhiễm từ B. dẫn điện tốt hơn
C. dễ bị gỉ hơn D. Nhiệt độ nóng chảy thấp hơn
Câu 56: Gang và thép là hợp kim của Fe. Tìm phát biểu đúng.
A. Gang là hợp kim Fe – C (trong đó C chiếm 5 đến 10%).
B. Nguyên tắc sản suất gang là khử Fe trong oxit bằng CO, H2 hay Al ở nhiệt độ cao.
C. Nguyên tắc sản xuất thép là oxi hoá các tạp chất trong gang. (C, Si, Mn, S, P) thành oxit nhằm giảm hàm lượng của chúng.
D. Thép là hợp kim Fe –C (trong đó C chiếm 2 và 5%).
Câu 57: Chất X có công thức phân tử C2H4O2. Cho chất X tác dụng với dung dịch NaOH tạo ra muối và nước. Chất X thuộc loại
A. ancol no đa chức. B. axit không no đơn chức.
C. este no đơn chức. D. axit no đơn chức.
Câu 58: Thủy phân este có công thức phân tử C4H8O2 (với xúc tác axit), thu được 2 sản phẩm hữu cơ X và Y. Từ X có thể điều chế trực tiếp ra Y. Vậy chất X là
A. rượu etylic. B. rượu metylic. C. axit fomic. D. etyl axetat.
Câu 59: Cho biết các phản ứng xảy ra sau: 2FeBr2 + Br2 → 2FeBr3; 2NaBr + Cl2 → NaCl + Br2
Phát biểu nào sau đây đúng?
A. Tính khử của Cl- mạnh hơn Br-
B. Tính oxi hoá của Cl2 mạnh hơn của Fe3+
C. Tính oxi hoá của Br2 mạnh hơn Cl2.
D. Tính khử của Br- mạnh hơn Fe2+
Câu 60: Hòa tan hoàn toàn 7,6 gam chất rắn X gồm Cu, Cu2S và S bằng HNO3 dư thấy thoát ra 5,04 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y được m gam kết tủa. Giá trị m là
A. 28,9625 gam. B. 20,3875 gam. C. 27,7375 gam. D. 7,3500 gam.
Câu 61: Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. dung dịch sau phản ứng chứa (không tạo muối NH4NO3)
A. Zn(NO3)2; Fe(NO3)3. B. Zn(NO3)2; Fe(NO3)2; HNO3
C. Zn(NO3)2; Fe(NO3)3; Cu(NO3)2. D. Zn(NO3)2; Fe(NO3)2; Cu(NO3)2.
Câu 62: Hỗn hợp X gồm Ba và Al. Cho m gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc). Mặt khác, hòa tan hoàn toàn m gam X bằng dung dịch NaOH, thu được 15,68 lít khí H2 (đktc). Giá trị của m là
A. 29,9 B. 16,4 C. 24,5 D. 19,1
Câu 63: Thủy phân hoàn toàn 0,1 mol este X bằng NaOH, thu được một muối của axit cacboxylic Y và 7,6 gam ancol Z. Chất Y có phản ứng tráng bạc, Z hòa tan được Cu(OH)2 tạo dung dịch màu xanh lam công thức cấu tạo của X là
A. HCOOCH2CH2OOCCH3. B. HCOOCH2CH(CH3)OOCH.
C. CH3COOCH2CH2OOCCH3. D. HCOOCH2CH2CH2OOCH.
Câu 64: Cho sơ đồ
![]()
Y, Z, E (dung dịch) và (1), (2) lần lượt là
A. H2SO4 đặc nguội, NaOH, Ba(OH)2, HCl, t0, điện phân nóng chảy.
B. H2SO4 loãng, NaOH đủ, Ba(OH)2, HCl đủ, t0, điện phân nóng chảy.
C. H2SO4 loãng, NaOH dư, Ba(OH)2, HCl, t0, điện phân nóng chảy.
D. H2SO4 đặc nóng, NaOH dư, Ba(OH)2, HCl, t0, điện phân nóng chảy.
Câu 65: Cho 11,2 gam Fe tác dụng hết với 5,6 lít Clo (đktc) thu được chất rắn X. Hòa tan X vào nước thu được dung dịch Y, cô cạn Y thu được m gam muối. Tính khối lượng muối trong Y:
A. 32,5gam B. 25,4 gam C. 28,95 gam D. 27,08 gam
Câu 66: Cho 1,68g bột sắt và 0,36g bột Mg tác dụng với 375ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82g. Nồng độ mol/l của CuSO4 trong dung dịch trước phản ứng là
A. 0,15M B. 0,2 C. 0,1M D. 0,05M
Câu 67: Este X no, đơn chức, mạch hở, không có phản ứng tráng bạc. Đốt cháy 0,1 mol X rồi cho sản phẩm cháy hấp thụ hoàn toàn vào dung dịch nước vôi trong có chứa 0,22 mol Ca(OH)2 thì vẫn thu được kết tủa. Thuỷ phân X bằng dung dịch NaOH thu được 2 chất hữu cơ có số nguyên tử cacbon trong phân tử bằng nhau. Phần trăm khối lượng của oxi trong X là
A. 37,21%. B. 36,36%. C. 43,24%. D. 53,33%.
Câu 68: Amino axit X có dạng H2NRCOOH (R là gốc hiđrocacbon). Cho 0,1 mol X phản ứng hết với dung dịch HCl (dư) thu được dung dịch chứa 11,15 gam muối. Tên gọi của X là
A. glyxin. B. valin. C. alanin. D. phenylalanin.
Câu 69: Cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2. Kết quả thí nghiệm được biểu diễn ở đồ thị dưới đây. Giá trị của a, b tương ứng là
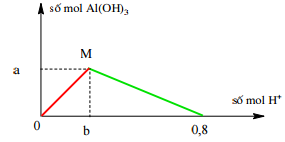
A. 0,2 và 0,2. B. 0,2 và 0,4. C. 0,2 và 0,3. D. 0,3 và 0,2.
Câu 70: Hỗn hợp khí X gồm đimetylamin và hai hiđrocacbon đồng đẳng liên tiếp. Đốt cháy hoàn toàn 100 ml hỗn hợp X bằng một lượng oxi vừa đủ, thu được 550 ml hỗn hợp Y gồm khí và hơi nước. Nếu cho Y đi qua dung dịch axit sunfuric đặc (dư) thì còn lại 250 ml khí (các thể tích khí và hơi đo ở cùng điều kiện). Công thức phân tử của hai hiđrocacbon là
A. CH4 và C2H6. B. C2H4 và C3H6. C. C2H6 và C3H8. D. C3H6 và C4H8.
Câu 71: Trong các thí nghiệm sau:
1. Thêm từ từ dung dịch H2S vào ống nghiệm chứa dung dịch FeCl3, thấy xuất hiện kết tủa màu nâu đỏ.
2. Nhỏ từ từ dung dịch FeSO4 dư vào ống nghiệm chứa dung dịch hỗn hợp KMnO4 và H2SO4, thấy dung dịch trong ống nghiệm mất màu tím và chuyển dần sang không màu.
3. Nhỏ từ từ dung dịch Na2S vào dung dịch AlCl3, thấy xuất hiện kết tủa trắng keo và có bọt khí không màu, không mùi bay ra.
4. Đổ từ từ dung dịch ZnCl2 vào dung dịch Na2S thấy xuất hiện kết tủa màu đen và không có khí thoát ra.
5. Nhỏ từ từ từng giọt dung dịch Na2CO3 vào dung dịch HCl, ban đầu không thấy có khí thoát ra, tiếp tục nhỏ thì thấy xuất hiện bọt khí không màu thoát ra.
6. Nhúng hai thanh sắt vào hai bình đựng dung dịch H2SO4 loãng (có nồng độ và thể tích bằng nhau), trong đó có một dung dịch được nhỏ trước vài giọt ZnSO4. Ta thấy thanh sắt nhúng trong dung dịch H2SO4 có nhỏ thêm vài giọt ZnSO4 sẽ tan nhanh hơn thanh sắt nhúng trong dung dịch chỉ chứa H2SO4.
Số thí nghiệm mô tả không đúng hiện tượng là
A. 4 B. 6 C. 5 D. 3
Câu 72: Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là
A. 97,20 B. 91,00 C. 98,20 D. 98,75
Câu 73: Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 (dư) qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Cho Na vào dung dịch MgSO4.
(e) Đốt FeS2 trong không khí.
(f). Điện phân dung dịch Cu(NO3)2 với các điện cực trơ
Số thí nghiệm không tạo thành kim loại là
A. 4 B. 2 C. 5 D. 3
Câu 74: Cho từ từ đến dư dung dịch NaOH lần lượt vào các dung dịch đựng Na+ (1), Al3+ (2), Mg2+ (3) ta quan sát thấy
A. ở (1) không hiện tượng, ở (3) xuất hiện kết tủa trắng, không tan.
B. ở (1) không hiện tượng, ở (2) và (3) xuất hiện kết tủa trắng rồi tan.
C. ở (1) không hiện tượng, ở (2) xuất hiện kết tủa trắng, không tan.
D. ở (1) không hiện tượng, ở (2) xuất hiện kết tủa trắng rồi tan, ở (3) xuất hiện kết tủa trắng không tan.
Câu 75: Hai hợp chất hữu cơ X và Y có cùng công thức phân tử là C3H7NO2, đều là chất rắn ở điều kiện thường. Chất X phản ứng với dung dịch NaOH, giải phóng khí. Chất Y có phản ứng trùng ngưng. Các chất X và Y lần lượt là
A. axit 2-aminopropionic và axit 3-aminopropionic.
B. axit 2-aminopropionic và amoni acrylat.
C. vinylamoni fomat và amoni acrylat.
D. amoni acrylat và axit 2-aminopropionic.
Câu 76: Hỗn hợp X gồm 3 este đơn chức, tạo thành từ cùng một ancol Y với 3 axit cacboxylic (phân tử chỉ có nhóm -COOH); trong đó, có hai axit no là đồng đẳng kế tiếp nhau và một axit không no (có đồng phân hình học, chứa một liên kết đôi C=C trong phân tử). Thủy phân hoàn toàn 5,88 gam X bằng dung dịch NaOH, thu được hỗn hợp muối và m gam ancol Y. Cho m gam Y vào bình đựng Na dư, sau phản ứng thu được 896 ml khí (đktc) và khối lượng bình tăng 2,48 gam. Mặt khác, nếu đốt cháy hoàn toàn 5,88 gam X thì thu được CO2 và 3,96 gam H2O. Phần trăm khối lượng của este không no trong X là
A. 38,76% B. 40,82% C. 34,01% D. 29,25%
Câu 77: Amino axit X có công thức H2NCxHy(COOH)2. Cho 0,1 mol X vào 0,2 lít dung dịch H2SO4 0,5M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với dung dịch gồm NaOH 1M và KOH 3M, thu được dung dịch chứa 36,7 gam muối. Phần trăm khối lượng của oxi trong X là
A. 24,06%. B. 9,524%. C. 10,687%. D. 48,12%.
Câu 78: X là hỗn hợp gồm Mg và MgO (trong đó Mg chiếm 60% khối lượng). Y là dung dịch gồm H2SO4 và NaNO3. Cho 6 gam X tan hoàn toàn vào Y, thu được dung dịch Z (chỉ chứa ba muối trung hòa) và hỗn hợp hai khí (gồm khí T và 0,04 mol H2). Cho dung dịch BaCl2 dư vào Z, thu được 55,92 gam kết tủa. Biết Z có khả năng tác dụng vừa đủ với dung dịch chứa 0,44 mol NaOH. Khí T là
A. NO. B. N2. C. NO2. D. N2O.
Câu 79: Đun nóng m gam hỗn hợp gồm a mol tetrapeptit mạch hở X và 2a mol tripeptit mạch hở Y với 600 ml dung dịch NaOH 1M (vừa đủ). Sau khi các phản ứng kết thúc, cô cạn dung dịch thu được 72,48 gam muối khan của các amino axit đều có một nhóm –COOH và một nhóm –NH2 trong phân tử. Giá trị của m là
A. 51,72. B. 66,00. C. 54,30. D. 44,48.
Câu 80: Đem nhiệt phân hoàn toàn a mol Fe(NO3)2 thu được hỗn hợp khí X có tỉ khối so với H2 bằng T1. Nhiệt phân hoàn toàn a mol Fe(NO3)3 thu được hỗn hợp khí Y có tỉ khối so với H2 bằng T2. Biểu thức nào dưới đây là đúng:
A. T2 = 0,972T1 B. T1 = T2 C. T1 = 0,972T2 D. T2 = 1,08T1
Đáp án đề thi thử THPT Quốc gia năm 2017 môn Hóa học
|
41, A 42, A 43, D 44, D |
45, A 46, C 47, C 48, A |
49, D 50, C 51, D 52, B |
53, B 54, A 55, A 56, C |
57, D 58, A 59, B 60, C |
61, A 62, C 63, B 64, B |
65, C 66, C 67, B 68, A |
69, A 70, B 71, C 72, C |
73, A 74, D 75, D 76, C |
77, D 78, A 79, A 80, A |

