Giải bài tập Hóa học 12 SBT bài 31
Hóa học 12 - Sắt
VnDoc xin giới thiệu tới các bạn tài liệu Giải bài tập Hóa học 12 SBT bài 31. Nội dung tài liệu kèm theo lời giải chi tiết sẽ giúp các bạn học sinh rèn luyện giải Hóa học 12 hiệu quả hơn. Mời các bạn tham khảo.
Giải bài tập Hóa học 12 SBT
Bài 7.1, 7.2, 7.3, 7.4, 7.5, 7.6 trang 71 sách bài tập (SBT) Hóa học 12
7.1. Fe có số hiệu nguyên tử là 26. Ion Fe3+ có cấu hình electron là
A. [Ar]3d64s2.
B. [Ar]3d6.
C. [Ar]3d34s2
D. [Ar]3d5.
7.2.Fe có thể tác dụng hết với dung dịch chất nào sau đây?
A. AlCl3.
B. FeCl3.
C. FeCl2.
D. MgCl2.
7.3. Cho 1,4 g kim loại X tác dụng với dung dịch HCl thu được dung dịch muối trong đó kim loại có sô oxi hoá +2 và 0,56 lít H2 (đktc). Kim loại X là
A. Mg.
B. Zn.
C. Fe.
D. Ni.
7.4. Cho m gam Fe tác dụng với dung dịch HNO3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là
A. 11,2.
B. 1,12.
C. 0,56.
D. 5,60.
7.5. Cho 8 g hỗn hợp bột kim loại Mg và Fe tác dụng hết với dung dịch HC1 thấy thoát ra 5,6 lít H2 (đktc). Khối lượng muối tạo ra trong dung dịch là
A. 22,25 g.
B. 22,75 g.
C. 24,45 g.
D. 25,75 g.
Cho m gam hỗn hợp Al và Fe phản ứng hoàn toàn với dung dịch HNO3 loãng thu được 2,24 lít NO duy nhất (đktc). Mặt khác cho m gam hỗn hợp này phản ứng với dung dịch HCl thu được 2,80 lít H2 (đktc). Giá trị của m là
A. 8,30.
B. 4,15.
C. 4,50.
D. 6,95.
Hướng dẫn trả lời:
7.1. D
7.2. B
7.3. C
7.4. B
7.5. D
7.6. B
7.5. Chọn D
![]() \({n_{{H_2}}} = {{5,6} \over {22,4}} = 0,25\left( {mol} \right) \Rightarrow {n_H} = 0,5\,mol\)
\({n_{{H_2}}} = {{5,6} \over {22,4}} = 0,25\left( {mol} \right) \Rightarrow {n_H} = 0,5\,mol\)
Khi có 0,5 mol nguyên tử H thoát ra thì cũng có 0,5 mol ion Cl- tạo muối.
mmuối = mkim loại + mgốc axit
mmuối = 8 + 35,5. 0,5 = 25,75 (g)
7.6 Chọn B
![]() \(\overline M + 4HN{O_3} \to \overline M {\left( {N{O_3}} \right)_3} + NO + 2{H_2}O\)
\(\overline M + 4HN{O_3} \to \overline M {\left( {N{O_3}} \right)_3} + NO + 2{H_2}O\)
0,1 0,1(mol)
![]() \(2Al + 6HCl \to 2AlC{l_3} + 3{H_2}\)
\(2Al + 6HCl \to 2AlC{l_3} + 3{H_2}\)
x ![]() \({{3x} \over 2}\left( {mol} \right)\)
\({{3x} \over 2}\left( {mol} \right)\)
![]() \(Fe + 2HCl \to FeC{l_2} + {H_2}\)
\(Fe + 2HCl \to FeC{l_2} + {H_2}\)
y y(mol)
![]() \(x + y = 0,1 \Rightarrow 3x + 3y = 0,3\,\,\,\,\,\,\,\,\left( 1 \right)\)
\(x + y = 0,1 \Rightarrow 3x + 3y = 0,3\,\,\,\,\,\,\,\,\left( 1 \right)\)
![]() \({{3x} \over 2} + y = {{2,8} \over {22,4}} \Rightarrow 3x + 2y = 0,25\,\,\,\,\,\,\left( 2 \right)\)
\({{3x} \over 2} + y = {{2,8} \over {22,4}} \Rightarrow 3x + 2y = 0,25\,\,\,\,\,\,\left( 2 \right)\)
Từ (1) và (2) ⟹ y = 0,05; x = 0,05
m = 27. 0,05 + 56. 0,05 = 4,15 (g)
Bài 7.7, 7.8, 7.9, 7.10 trang 72 sách bài tập (SBT) Hóa học 12
7.7. Phát biểu nào dưới đây không đúng?
A. Fe là kim loại chuyển tiếp, thuộc chu kì 4, nhóm VIIIB, ô số 26 trong bảng tuần hoàn.
B. Fe là nguyên tố d, cấu hình electron là [Ar]3d64s2.
C. Khi tạo ra các ion sắt, nguyên tử Fe nhường electron ở phân lớp 3d trước phân lớp 4s.
D. Tương tự nguyên tố Cr, nguyên tử Fe khi tham gia phản ứng không chỉ nhường electron ở phân lớp 4s mà còn có thể nhường thêm electron ở phân lớp 3d.
7.8. Cấu hình electron nào dưới đây viết đúng?
A.26Fe : [Ar]4s23d6.
B. 26Fe2+ : [Ar]4s23d4
C. 26Fe2+ : [Ar]3d44s2.
D.26Fe3+ : [Ar]3d5.
7.8. Nhận định nào dưới đây không đúng?
A. Fe dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d để trở thành ion Fe3+
B. Fe là kim loại có tính khử trung bình: Fe có thể bị oxi hoá thành Fe2+ hoặc Fe3+.
C. Khi tạo ra các ion Fe, nguyên tử Fe nhường electron ở phân lớp 4s trước phân lớp 3d.
D. Fe là kim loại có tính khử mạnh: Fe có thể bị oxi hoá thành Fe2+ hoặc Fe3+
7.10. Tính chất đặc biệt của Fe là:
A. nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. dẫn điện yà dẫn nhiệt tốt.
C. kim loại nặng, dẻo, dễ rèn.
D. tính nhiễm từ
Hướng dẫn trả lời:
7.7. C
7.8. D
7.9. D
7.10. D
Bài 7.11, 7.12, 7.13, 7.14 trang 73 sách bài tập (SBT) Hóa học 12
7.11. Phương trình hoá học nào dưới đây viết sai?
![]() \(A.\,\,3Fe + 2{O_2}\buildrel {{t^0}} \over\longrightarrow F{e_3}{O_4}\)
\(A.\,\,3Fe + 2{O_2}\buildrel {{t^0}} \over\longrightarrow F{e_3}{O_4}\)
![]() \(B.\,\,2Fe + 3Cl \to 2FeC{l_3}\)
\(B.\,\,2Fe + 3Cl \to 2FeC{l_3}\)![]() \(B.\,\,2Fe + 3Cl \to 2FeC{l_3}\)
\(B.\,\,2Fe + 3Cl \to 2FeC{l_3}\)
![]() \(D.\,\,3Fe + \,4{H_2}O\buildrel { < {{570}^0}C} \over
\longrightarrow F{e_3}{O_4} + 4{H_2}\)
\(D.\,\,3Fe + \,4{H_2}O\buildrel { < {{570}^0}C} \over
\longrightarrow F{e_3}{O_4} + 4{H_2}\)
7.12. Nhận định nào dưới đây không đúng?
A. Fe khử dễ dàng H+ trong dung dịch HCl, H2SO4 loãng thành H2, Fe bị oxi hoá thành Fe2+.
B. Fe bị oxi hoá bởi HNO3, H2S04 đặc nóng thành Fe3+.
C. Fe không tác dụng với HNO3 và H2S04 đặc, nguội.
D. Fe khử được những ion kim loại đứng trước nó trong dãy điện hoá.
7.13. Fe tác dụng được với dung dịch muối FeCl3 theo phản ứng: Fe + 2FeCl3→ 3FeCl2 là do:
A. mọi kim loại đều có thể tác dụng với dung dịch muối của nó.
B. Fe có thể khử ion Fe3+ xuống ion Fe2+.
C. Ion Fe2+ có tĩnh oxi hoá mạnh hơn ion Fe3+.
D. Ion Fe2+ có tính khử mạnh hơn Fe.
7.14. Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HC1 20% thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%
B. 28,21%
C. 15,76%
D. 11,79%
Hướng dẫn trả lời:
7.11. C
7.12. D
7.13. B
7.14. D
7.14. Chọn D
Đặt số mol Fe và Mg lần lượt là x, y ⟹ số mol HCl phản ứng là 2(x + y).
Khối lượng dung dịch sau phản ứng gồm: mKL + mdung dịch HCL – mH2.
![]() \(\Leftrightarrow {m_{dd}} = 56x + 24y + 73\left( {x + y} \right).{{100} \over {20}} - 2\left( {x + y} \right)\)
\(\Leftrightarrow {m_{dd}} = 56x + 24y + 73\left( {x + y} \right).{{100} \over {20}} - 2\left( {x + y} \right)\) ![]() \(= 419x + 387y\left( {gam} \right)\)
\(= 419x + 387y\left( {gam} \right)\)
Ta có:
![]() \(C\% \left( {FeC{l_2}} \right) = {{127x} \over {419x + 387y}} = 15,76\)
\(C\% \left( {FeC{l_2}} \right) = {{127x} \over {419x + 387y}} = 15,76\)
![]() \(\Leftrightarrow x \approx y\)
\(\Leftrightarrow x \approx y\)
![]() \(\Rightarrow C\% \left( {MgC{l_2}} \right) = {{95y} \over {419x + 387y}}.100\)
\(\Rightarrow C\% \left( {MgC{l_2}} \right) = {{95y} \over {419x + 387y}}.100\)
![]() \(= {{95x} \over {419x + 387x}}.100 = 11,79\%\)
\(= {{95x} \over {419x + 387x}}.100 = 11,79\%\)
Bài 7.15 trang 73 sách bài tập (SBT) Hóa học 12
Tính chất hoá học cơ bản của sắt là gì? Nguyên nhân? Lấy các thí dụ để minh hoạ.
Hướng dẫn trả lời:
Tính chất hoá học cơ bản của sắt là tính khử. Tuỳ thuộc vào chất oxi hoá mà sắt có thể bị oxi hoá đến số oxi hoá +2 hoặc +3. Nguyên nhân là sắt dễ nhường 2e ở phân lớp 4s để thành ion Fe2+ và có thể nhường thêm le ở phân lớp 3d để thành ion Fe3+, tuỳ thuộc vào khả năng thu electron của chất oxi hoá.
Ví dụ:
 \(\matrix{{Fe{\rm{ }} + {\rm{ }}{I_2}\buildrel {{t^0}} \over\longrightarrow Fe{I_2}} \hfill \cr {2Fe{\rm{ }} + {\rm{ }}3C{l_2}\buildrel {{t^0}} \over\longrightarrow 2FeC{l_3}} \hfill \cr}\)
\(\matrix{{Fe{\rm{ }} + {\rm{ }}{I_2}\buildrel {{t^0}} \over\longrightarrow Fe{I_2}} \hfill \cr {2Fe{\rm{ }} + {\rm{ }}3C{l_2}\buildrel {{t^0}} \over\longrightarrow 2FeC{l_3}} \hfill \cr}\)
Bài 7.16 trang 74 sách bài tập (SBT) Hóa học 12
Đốt một kim loại trong bình kín đựng khí clo thu được 32,5 g muối clorua và nhận thấy thể tích khí clo trong bình giảm 6,72 lít (đktc). Hãy xác định tên của kim loại đã dùng.
Hướng dẫn trả lời:
Gọi kim loại là M, có hoá trị n.
2M + nCl2 → 2MCln
Theo phương trình hoá học, cứ:
n mol Cl2 thu được 2 mol muối
Vậy ![]() \({{6,72} \over {22,4}} = 0,3\) (mol) Cl2 thu được
\({{6,72} \over {22,4}} = 0,3\) (mol) Cl2 thu được ![]() \({{32,5} \over {M + 32,5n}}\) muối
\({{32,5} \over {M + 32,5n}}\) muối
Do đó ta có: ![]() \(n.{{32,5} \over {M + 32,5n}} = 2.0,3 \to M = {{56n} \over 3}\)
\(n.{{32,5} \over {M + 32,5n}} = 2.0,3 \to M = {{56n} \over 3}\)
Vì n là số nguyên, dương nên chỉ có n = 3 và M = 56 là hợp lí. Vậy kim loại đã dùng là Fe.
Bài 7.17 trang 74 sách bài tập (SBT) Hóa học 12
Sắt tác dụng như thế nào với dung dịch đặc và loãng của các axit HCl, H2SO4, HNO3 ở nhiệt độ thường và nhiệt độ cao? Viết phương trình hoá học của các phản ứng.
Hướng dẫn trả lời:
Fe + 2HCl(l) → FeCl2 + H2
2Fe + 3H2SO4(l) → Fe2(SO4)3 + 3H2
2Fe + 6H2SO4(đ) ![]() \(\overset{t^{0} }{\rightarrow}\) Fe2(SO4)3 + 6SO2 + 3H2O
\(\overset{t^{0} }{\rightarrow}\) Fe2(SO4)3 + 6SO2 + 3H2O
Fe + H2SO4 (đ, nguội) → không phản ứng
Fe+ 4HNO3 (l) → Fe(NO3)3 + NO + 2H2O
Fe + HNO3 (đ, nguội) → không phản ứng
Fe + HNO3(đ) ![]() \(\overset{t^{0} }{\rightarrow}\) Fe(NO3)3 + 3NO2 + 3H2O.
\(\overset{t^{0} }{\rightarrow}\) Fe(NO3)3 + 3NO2 + 3H2O.
Bài 7.18 trang 74 sách bài tập (SBT) Hóa học 12
Đốt nóng một lượng bột sắt trong bình đựng khí O2, sau đó để nguội và cho vào bình một lượng dư dung dịch HCl. Viết phương trình hoá học của các phản ứng có thể xảy ra
Hướng dẫn trả lời:
Đốt Fe trong khí O2, sản phẩm có thể là FeO, Fe3O4, Fe2O3 và Fe (dư).
Cho dd HCl vào có các phản ứng:
FeO + 2HCl → FeCl2 + H2O
Fe + 2HCl(l) → FeCl2 + H2
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + H2O
Fe2O3 + 6HCl → 2FeCl2 + 3H2O
Fe + 2FeCl3 → 3FeCl2
Bài 7.19 trang 74 sách bài tập (SBT) Hóa học 12
Cho 3,04 g hỗn hợp bột kim loại sắt và đồng tác dụng hết với dung dịch HNO3 loãng, thu được 0,896 lít khí NO duy nhất (đktc). Xác định thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Hướng dẫn trả lời:
Fe+ 4HNO3 (l) → Fe(NO3)3 + NO + 2H2O (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
Đặt x và y la số mol Fe và Cu trong hỗn hợp ta có hệ pt:
56x + 64y = 3,04
![]() \(x + {{2y} \over 3} = 0,04\)
\(x + {{2y} \over 3} = 0,04\)
→ x= 0,02 , y= 0,03
![]() \(\% {m_{Fe}} = {{56.0,02} \over {3,04}}.100 = 36,8\%\)
\(\% {m_{Fe}} = {{56.0,02} \over {3,04}}.100 = 36,8\%\)
%m Cu= 100 – 36,8= 63,2%.
Bài 7.20 trang 74 sách bài tập (SBT) Hóa học 12
Hoà tan 4 gam một đinh sắt đã bị gỉ trong dung dịch H2SO4 loãng, dư tách bỏ phần không tan được dung dịch A. Dung dịch A này phản ứng vừa hêt với 100 ml dung dịch KMnO4 0,1M. Tính % tạp chất trong đinh sắt giả sử gỉ sắt không phản ứng với dung dịch axit.
Hướng dẫn trả lời:
Giả sử phần oxit không phản ứng, vậy chỉ có sắt nguyên chất phản ứng, thứ tự phản ứng như sau:
![]() \(Fe\buildrel {{H_2}S{O_4}(l)} \over\longrightarrow F{e^{2 + }}\)
\(Fe\buildrel {{H_2}S{O_4}(l)} \over\longrightarrow F{e^{2 + }}\)
phương trình cho - nhận e:
Fe2+→ Fe3+ + le Mn7+O4- + 5e → Mn2+
Số mol KMnO4 là 0,01mol ⟹ n Fe3+ = 0,05
⟹ nFe = nFe 2+ = nFe 3+ = 0,05 (mol)
⟹ nFe = 56.0,05 = 2,8 (gam) ⟹ m tạp chất = 1,2 (gam)
⟹ % tạp chất = ![]() \({{1,2} \over 4}.100\% {\rm{ }} = {\rm{ }}30\%\)
\({{1,2} \over 4}.100\% {\rm{ }} = {\rm{ }}30\%\)
Bài 7.21 trang 74 sách bài tập (SBT) Hóa học 12
Cho Fe tác dụng với dung dịch HNO3 thấy sinh ra hỗn hợp khí gồm 0,03 mol NO2 và 0,02 mol NO. Xác định khối lượng Fe đã phản ứng.
Hướng dẫn trả lời:
Sử dụng phương trình cho - nhận e và áp dụng ĐLBTĐT, ta có:
Fe→ Fe3+ + 3e
0,03 ← 0,09
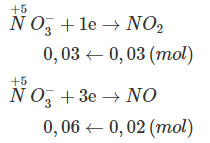
⟹ Khối lượng Fe phản ứng: mFe = 1,68 (g).
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


