Đề thi thử THPT Quốc gia môn Hóa học lần 2 năm 2015 trường THPT Lương Ngọc Quyến, Thái Nguyên
Đề thi thử THPT Quốc gia môn Hóa học
Đề thi thử THPT Quốc gia môn Hóa học lần 2 năm 2015 trường THPT Lương Ngọc Quyến, Thái Nguyên gồm 50 câu hỏi trắc nghiệm có đáp án đi kèm. Đây là tài liệu ôn thi THPT Quốc gia và luyện thi đại học môn Hóa hữu ích dành cho các bạn thí sinh. Mời các bạn tham khảo.
Đề thi thử Quốc gia lần 1 năm 2015 môn Hóa học trường THPT Phú Riềng, Bình Phước
Đề thi thử THPT Quốc gia năm 2015 môn Hóa học trường THPT Chuyên Thăng Long, Lâm Đồng
|
SỞ GD & ĐT THÁI NGUYÊN |
ĐỀ THI THỬ THPT QUỐC GIA LẦN II NĂM 2015 |
||
|
Họ và tên thí sinh:……...……...…….….Phòng thi:........ SBD: ..……....... |
Mã đề 132 |
||
Thí sinh không được dùng Bảng Tuần Hoàn các nguyên tố Hóa Học.
(Cho biết nguyên tử khối của các nguyên tố: H=1; C=12; N=14; O=16; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Cr=52; Mn=55; Fe=56; Cu=64; Zn=65; Br=80; Ag=108; Ba=137)
Câu 1. Để 2,52 gam bột sắt trong không khí, sau một thời gian thu được 2,84 gam hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4. Để hòa tan hết X cần 500 ml dung dịch HNO3 a (mol/l), sau phản ứng sinh ra 0,56 lít NO (sản phẩm khử duy nhất ở đktc) và dung dịch Y. Giá trị của a và khối lượng chất tan trong Y là:
A. 0,25M và 6,95 gam. B. 0,025M và 6,95 gam.
C. 0,28 M và 9,65 gam. D. 0,028M và 9,65 gam.
Câu 2. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3p1. Số hiệu nguyên tử của nguyên tố X là:
A. 13. B. 11. C. 12. D. 14
Câu 3. Cho dãy chất: Al, Al(OH)3, Al2O3, AlCl3. (NH4)2CO3, CH3COONH4, NaHCO3. Số chất có tính chất lưỡng tính là:
A. 7. B. 2. C. 6. D. 5.
Câu 4. Thủy phân este X trong môi trường axit, thu được 2 chất hữu cơ Y và Z. Oxi hóa Y tạo ra sản phẩm là Z. Chất X không thể là:
A. Isopropyl propionat. B. Etylen glicol oxalat. C. Etyl axetat. D. Vinyl axetat.
Câu 5. Khẳng định nào sau đây là sai?
A. Nước cứng làm cho xà phòng ít bọt, giảm khả năng tẩy rửa của xà phòng.
B. Nguyên tắc làm mềm nước cứng là giảm nồng độ Ca2+, Mg2+, trong nước.
C. CaSO4.2H2O có trong tự nhiên, là thạch cao sống.
D. Al(OH)3 là bazơ lưỡng tính.
Câu 6. Cho 2,760 gam chất hữu cơ A (chứa C, H, O và có 100 < MA< 150) tác dụng với NaOH vừa đủ, sau đó làm khô, phần bay hơi chỉ có nước, phần chất rắn khan còn lại chứa hai muối của natri có khối lượng 4,440 gam. Nung nóng 2 muối trong oxi dư, sau khi phản ứng xảy ra hoàn toàn thu được 3,180 gam Na2CO3, 2,464 lít CO2 (ở đktc) và 0,900 gam nước. Công thức phân tử và số đồng phân cấu tạo của A là:
A. C7H6O3; 3. B. C7H6O3; 2. C. C6H6O3; 3. D. C6H6O3; 2.
Câu 7. Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng với điện cực trơ là:
A. Cu, Ca, Zn. B. Fe, Cr, Al. C. Li, Ag,Sn. D. Ni, Cu, Ag.
Câu 8. Cho các phản ứng:
![]()
(2) H2S + O2 →
(3) CaOCl2 + HCl đặc →
(4) Al + dung dịch NaOH →
(5) F2 + H2O →
(6) Na2S2O3 + dung dịch H2SO4 →
Số phản ứng tạo ra đơn chất là:
A. 6. B. 4. C. 5. D. 3.
Câu 9. Cho các chất: Cu(NO3)2, AgNO3, Fe(NO3)2, MgCO3, NH4NO3, Ba(HCO3)2 và NH4HCO3. Nếu nung các chất trên đến khối lượng không đổi trong các bình kín không có không khí, rồi cho nước vào các bình. Số bình có thể tạo lại chất ban đầu sau các thí nghiệm là:
A. 3. B. 5. C. 2. D. 4.
Câu 10. Cho các dung dịch: NaOH, HCl, Br2, C2H5OH. Số dung dịch phản ứng được với phenol là:
A. 3. B. 2. C. 1. D. 4.
Câu 11. Chất nào sau đây phản ứng được với NaHCO3?
A. Anđehit axetic. B. Phenol. C. Axit benzoic. D. Ancol bezylic.
Câu 12. Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí, trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp gần nhất với giá trị nào sau đây:
A. 15. B. 20. C. 25. D. 30.
Câu 13. Cho phản ứng sau: ![]()
Để cân bằng trên chuyển dịch theo chiều thuận thì: (1) tăng tăng nhiệt độ, (2) tăng áp suất, (3) hạ nhiệt độ, (4) dùng xúc tác là V2O5, (5) giảm nồng độ SO3. Biện pháp đúng là:
A. 1, 2, 5. B. 2, 3, 5. C. 1, 2, 3, 4, 5. D. 2, 3, 4, 5.
Câu 14. Cho sơ đồ chuyển hóa
![]()
Tên gọi của Y là:
A. Propan -1,2 – điol. B. Propan – 1,3 - điol. C. Glixerol. D. Propan -2-ol.
Câu 15. Các nhận xét sau:
(a) Thành phần chính của phân đạm ure là (NH2)2CO.
(b) Phân đạm amoni nên bón cho loại đất chua.
(c) Tro thực vật cũng là một loại phân kali vì có chứa K2CO3.
(d) Độ dinh dưỡng của phân lân được đánh giá bằng phần trăm khối lượng photpho.
(e) NPK là một loại phân bón hỗn hợp.
(f) Người ta dùng loại phân bón chứa nguyên tố kali để tăng cường sức chống bệnh, chống rét và chịu hạn cho cây.
Số nhận xét sai là :
A. 3. B. 4. C. 2. D. 1.
Câu 16. Cho 23,06 gam hỗn hợp hai muối MgCO3 và RCO3 vào dung dịch H2SO4 loãng, thu được 0,896 lít khí CO2 (đktc), chất rắn X và dung dịch Y chứa 2,4 gam muối. Nung X đến khối lượng không đổi, thu được chất rắn Z và 2,24 lít khí CO2 (đktc). Khối lượng của Z là:
A. 17,1 gam. B. 15,3 gam. C. 17,7 gam. D. 15,5 gam.
Câu 17. Cho dung dịch KOH vào dung dịch hỗn hợp gồm a mol HCl và b mol CrCl3.
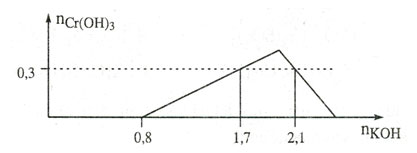
Tỉ lệ a : b là:
A. 1 : 2. B. 3 : 2. C. 2 : 1. D. 2 : 3.
Câu 18. Cho sơ đồ phản ứng:
X + Na[Al(OH)4] → M↓ + Y
Y + AgNO3 → AgCl + ...
X là:
A. HCl. B. NH3. C. SO2. D. CO2.
Câu 19. Hỗn hợp X chứa: NaHCO3, NH4NO3 và CaO (các chất có cùng số mol). Hòa tan hỗn hợp X vào H2O (dư), đun nóng. Sau phản ứng kết thúc, lọc bỏ kết tủa, thu được dung dịch Y. Dung dịch Y có môi trường:
A. Lưỡng tính. B. Axit. C. Bazơ. D. Trung tính.
Câu 20. Nung nóng m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần: Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). Phần 2 đem tác dụng với dung dịch NaOH dư, đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt là:
A. FeO và 19,32. B. Fe2O3 và 28,98.
C. Fe3O4 và 28,98. D. Fe3O4 và 19,32.
Đáp án đề thi thử THPT Quốc gia môn Hóa học
|
1 |
C |
11 |
C |
21 |
B |
31 |
A |
41 |
C |
|
2 |
A |
12 |
A |
22 |
A |
32 |
C |
42 |
B |
|
3 |
D |
13 |
B |
23 |
A |
33 |
B |
43 |
C |
|
4 |
A |
14 |
B |
24 |
D |
34 |
B |
44 |
D |
|
5 |
D |
15 |
C |
25 |
A |
35 |
A |
45 |
B |
|
6 |
A |
16 |
C |
26 |
B |
36 |
C |
46 |
A |
|
7 |
D |
17 |
C |
27 |
C |
37 |
D |
47 |
B |
|
8 |
A |
18 |
A |
28 |
C |
38 |
A |
48 |
B |
|
9 |
D |
19 |
D |
29 |
B |
39 |
D |
49 |
D |
|
10 |
B |
20 |
D |
30 |
D |
40 |
A |
50 |
C |

