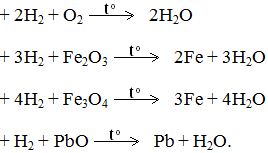Giáo án Hóa học 8 bài 34: Bài luyện tập 6
Giáo án Hóa học 8 bài 34
Giáo án Hóa học 8 bài 34: Bài luyện tập 6 được VnDoc.com tuyển chọn của các giáo viên đang giảng dạy ở các trường có tiếng trong cả nước sẽ giúp thầy cô giáo có thêm tư liệu tham khảo. Qua đó, giúp học sinh hiểu được các kiến thức và khái niệm hoá học về tính chất vật lý, tính chất hoá học (tính khử của H2), ứng dụng phương pháp điều chế khí H2 -> so sánh được với oxi. Thư viện VnDoc.com hi vọng giáo án này sẽ góp phần giúp các thầy cô có được một bài soạn hay.
Giáo án Hóa học 8 bài 33: Điều chế khí hidro - Phản ứng thế
Giáo án Hóa học 8 bài 35: Bài thực hành 5 Điều chế - Thu khí hiđro. Thử tính chất của khí hiđro
GIÁO ÁN HÓA HỌC LỚP 8
Bài 34: BÀI LUYỆN TẬP 6
I. MỤC TIÊU
1. Kiến thức: Học sinh được:
- Củng cố, hệ thống hoá các kiến thức và khái niệm hóa học về H2. Biết so sánh các tính chất và cách điều chế H2 so với O2.
- HS biết và hiểu các khái niệm phản ứng thế, sự khử, sự oxi hoá, chất khử, chất oxi hoá, phản ứng oxi hoá- khử.
- Nhận biết được phản ứng oxi hoá khử, biết nhận ra phản ứng thế & so sánh với các phản ứng hoá hợp & phản ứng phân huỷ.
2. Kĩ năng:
Rèn cho học sinh: Vận dụng các kiến thức trên đây để làm các bài tập và tính toán có tính tổng hợp liên quan đến O2 và H2.
II.CHUẨN BỊ:
- Đề bài tập 1, 2, 3 SGK/118, 119.
- Ôn lại kiến thức các bài 31, 32, 33.
1. Giáo viên: Đề bài tập 1, 2, 4 SGK/ 119
2. Học sinh: Ôn lại những kiến thức ở các bài 31, 32, 33.
III. HOẠT ĐỘNG DẠY – HỌC
1. Ổn định lớp: GV kiểm tra sĩ số vệ sinh lớp
2. Kiểm tra bài cũ:
Cần lấy bao nhiu gam kẻm, cho tc dụng với dung dịch HCl dư. Thì thu được bao nhiu gam kẽm clorua v 5,6 lít khí H2 (ĐKTC).
3. Vào bài mới
Ở chương V các em đã học xong về oxi; phản ứng oxi hóa - khử; phản ứng thế... Tiết học này các em sẽ được học bài luyện tập, để làm một số bài tập định tính và một số bài tập định lượng về những kiến thức trên qua bài học này.
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
|
|
Hoạt động 1: Kiến thức cần nhớ (15’) |
||
|
? Khí H2 có những tính chất hoá học như thế nào?
? Có mấy cách thu khí H2. ? Tại sao ta có thể thu được H2 bằng cách đẩy nước. ? Khi đốt cháy hỗn hợp H2 và O2 sẽ có hiện tượng gì. ? Kể tên các loại phản ứng đã học. ? Thế nào là phản ứng thế, cho ví dụ. ? Thế nào là phản ứng oxi hoá - khử, cho ví dụ. Bài tập: Các phản ứng sau là loại phản ứng nào?
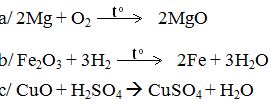
|
- HS 1: Trả lời lý thuyết. + Có tính khử. + Dễ: phản ứng với: Oxi (đơn chất). Oxi (hợp chất). - Đẩy nước và đẩy không khí. → Vì H2 tan rất ít trong nước.
- Hỗn hợp H2 và O2 cháy gây ra tiếng nổ. - Phản ứng: hóa hợp, phân huỷ, oxi hoá – khử và thế.
a/ Phản ứng hoá hợp. b/ Phản ứng oxi hoá - khử và thế. c/ Không có. |
|
|
Hoạt động 2: Luyện tập (27’) |
||
|
? Yêu cầu 2 HS làm bài tập 5 SGK/117. - Yêu cầu HS đọc và làm bài tập 1/SGK àGiải thích. ? Ngoài phản ứng oxi hoá – khử, các phản ứng trên còn thuộc loại phản ứng nào khác → cụ thể. - Yêu cầu HS làm bài tập 2 SGK/118. Hướng dẫn HS làm bài dưới dạng bảng. Cách thử O2 Không khí H2 Que đóm còn tàn than hồng. Bùng cháy Bình thường Không hiện tượng. Que đóm cháy. Bình thường Lửa màu xanh nhạt. Ngoài cách nhận biết trên, theo em còn có cách nhận biết khác không? Yêu cầu HS thảo luận cùng làm bài tập 4 SGK/119. - Gợi nhớ cho HS cách đọc tên các oxit. ? Các phản ứng trên thuộc loại phản ứng nào. ? Với phản ứng 5, chất nào là chất khử, chất nào là chất oxi hoá. - Yêu cầu HS đọc SGK à Thảo luận nhóm làm bài tập 6 SGK/ 119 * Hướng dẫn:Muốn biết chất nào tạo nhiều khí H2 nhất ta phải viết phương trình hóa học và so sánh khối lượng các kim loại tham gia phản ứng và thể tích chất tạo thành. - Yêu cầu các nhóm trình bày và chấm điểm.
|
- Bài tập 5 SGK/ 117 a. nFe dư = 0,15 (mol) mFe dư = 8,4 (g) b. Thể tích H2: 5,6 (l) - Bài tập 1 SGK/ 118
(Bốn phản ứng đều là phản ứng oxi hoá – khử). - Vì H2 chiếm O2 của các chất khác nên H2 là chất khử. Còn O2, PbO, Fe2O3, Fe3O4 đã nhường O2 à chất oxi hoá. Riêng phản ứng: 2H2 + O2 → 2H2O Còn là phản ứng hoá hợp. Các phản ứng khác còn là phản ứng thế. - Dùng que đóm còn than hồng đưa vào miệng 3 lọ: + Lọ làm que đóm → cháy: O2 + 2 lọ còn lại không có hiện tượng gì là không khí và H2. - Dùng que đóm cháy cho vào hai lọ không khí và H2. + Lọ cháy → màu xanh nhạt: H2. + Lọ không có hiện tượng gì là không khí. - Dùng que đóm còn than hồng → O2. - Nung nóng CuO à dẫn 2 khí còn lại vào à CuOđen → Cuđỏ là H2. 1/ CO2 + H2O → H2CO3 2/ SO2 + H2O → H2SO3 3/ Zn + 2HCl → ZnCl2 + H2 4/ P2O5 + 3H2O → 2H3PO4 5/ PbO + H2 → Pb + H2O. HS: - Phản ứng hoá hợp: 1, 2, 4. - Phản ứng oxi hoá – khử: 5. - Phản ứng thế: 3, 5. a. Zn + H2SO4 → H2 + ZnSO4 65g 22,4l 2Al + 3H2SO4 →3H2 + Al2(SO4)3 2.27g 3.22,4l Fe + H2SO4 → H2 + FeSO4 56g 22,4l |
|
|
b. Theo các PTHH, ta thấy: cùng 1 lượng kim loại tác dụng với lượng dư axit thì kim loại Al sẽ có nhiều khí H2 hơn. c. Nếu thu cùng 1 lượng khí H2 thì kim loại Al cần cho phản ứng là nhỏ nhất. |
||
IV. CỦNG CỐ - DẶN DỊ
- Bài tập về nhà: 1, 2, 3, 4 SGK/ 41
- Chuẩn bị bản tường trình, đọc trước các thí nghiệm trong bài thực hành.
|
STT |
Tên thí nghiệm |
Hoá chất |
Hiện tượng |
PTPƯ + giải thích |
|
1. 2. 3. |
Điều chế khí H2… Thu khí H2. H2 khử CuO |
V. RÚT KINH NGHIỆM SAU TIẾT DẠY:
...........................................................................................................................
...........................................................................................................................