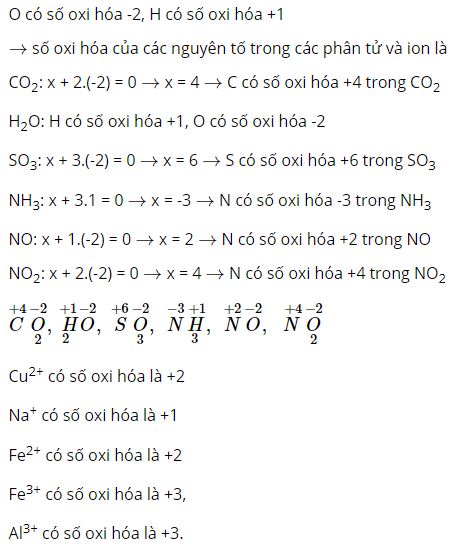Hóa học
-
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
18 4 câu trả lờiThích Bình luận Xem thêm 3 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
18 4 câu trả lờiThích Bình luận Xem thêm 3 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
5 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
5 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
92 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
92 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 10
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời