Đề thi học sinh giỏi môn Hóa học lớp 9 phòng GD&ĐT Nam Sách năm 2015 - 2016
Đề thi học sinh giỏi môn Hóa học lớp 9
Đề thi học sinh giỏi môn Hóa học lớp 9 năm học 2015 - 2016 phòng GD&ĐT Nam Sách là đề tham khảo dành cho các bạn học sinh và thầy cô nghiên cứu, học tập tốt môn Hóa lớp 9 cũng như luyện tập và làm quen với nhiều đề học sinh giỏi hơn nhằm chuẩn bị tốt nhất cho các kì thi sắp diễn ra. Mời các bạn tham khảo.
Đề thi học sinh giỏi môn Địa lý lớp 9 năm học 2015 - 2016 huyện Hoằng Hóa, Thanh Hóa
Đề thi học sinh giỏi môn Ngữ văn lớp 9 năm học 2013 - 2014 trường THCS Thanh Thùy, Hà Nội
| PHÒNG GD & ĐT NAM SÁCH | ĐỀ THI HỌC SINH GIỎI NĂM HỌC: 2015 - 2016 MÔN: Hóa học 9 Thời gian làm bài: 150 phút (không tính thời gian giao đề) (Đề này gồm 01 trang) |
ĐỀ BÀI
Câu 1. (2 điểm) Nêu hiện tượng, giải thích và viết PTHH xảy ra trong các thí nghiệm sau:
a, Nhỏ từ từ dd axit HCl đến dư vào dd Na2CO3.
b, Nhỏ dd Na2CO3 vào dd CuSO4.
Câu 2.(2 điểm) Nhiệt phân hoàn toàn 20g hỗn hợp: MgCO3, CaCO3, BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong được 10 g kết tủa và dung dịch C. Đun nóng dung dịch tới phản ứng hoàn toàn thấy tạo thêm 6 g kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào
Câu 3. (2 điểm)
1. Hấp thụ 5,6 lít khí CO2 (đkc) vào 400 ml dung dịch NaOH 1M nhận được dung dịch A. Hỏi trong A chứa muối gì với lượng bằng bao nhiêu?
2. Cho từ từ một luồng khí CO đi qua ống sứ đựng m gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 đun nóng thu được 64 gam sắt, khí đi ra sau phản ứng cho đi qua dung dịch Ca(OH)2 dư được 40 gam kết tủa. Tìm m?
Câu 4 (2 điểm). Hòa tan 5,33 gam hỗn hợp 2 muối RCln và BaCl2 vào nước được 200 gam dung dịch X. Chia X thành 2 phần bằng nhau:
Phần 1: Cho tác dụng với 100 g dung dịch AgNO3 8,5% thu được 5,74 g kết tủa X1 và dung dịch X2. Phần 2: Cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,165 gam kết tủa X3.
a. Xác định tên kim loại R và công thức hóa học RCln.
b. Tính nồng độ % các chất trong dung dịch X2
Câu 5: (2 điểm)
1. Viết PTHH hoàn thành sơ đồ chuyển hoá sau( Ghi rõ điều kiện phản ứng nếu có)
Fe→ FeCl3 ↔ FeCl2 → Fe(OH)2 → Fe(OH)3→ Fe2O3 → Fe3O4 → FeSO4
2. Tại sao khi đốt kim loại Fe, Al... thì khối lượng tăng lên còn khi đốt bông, vải sợi thì khối lượng lại giảm?
Biết: Fe = 56, Ca = 40, H = 1, Na = 23, Al = 27, O = 16, Cl = 35,5, C = 12, K = 39, N = 14, Ag = 108, Ba = 137.
Đáp án đề thi học sinh giỏi môn Hóa học lớp 9
Câu 1:
a. Nhỏ từ từ dd axit HCl đến dư vào dd Na2CO3.
Hiện tượng: Lúc đầu không có bọt khí thoát ra, sau đó mới có khí sủi bọt. (0,25đ)
Giải thích: Vì lúc đầu lượng Na2CO3 còn dư so với HCl cho vào (0,25đ)
PTHH: Na2CO3 + HCl→ NaHCO3 + NaCl (0,25đ)
Khi số mol HCl cho vào lớn hơn 2 lần số mol Na2CO3 trong dd thì có khí thoát ra khỏi dd. (0,25đ)
PTHH: NaHCO3 + HCl→ NaCl + CO2 + H2O (0,25đ)
b, Nhỏ dd Na2CO3 vào dd CuSO4.
Hiện tượng: Màu xanh của dd CuCl2 nhạt dần, có chất rắn màu xanh sinh ra và có bọt khí xuất hiện. (0,25đ)
Giải thích: 2 muối pư tạo ra CuCO3 nhưng ngay sau đó CuCO3 bị thuỷ phân tạo chất rắn Cu(OH)2 màu xanh và khí CO2 sủi bọt. (0,25đ)
PTHH: Na2CO3 + CuCl2 →CuCO3 + 2NaCl (0,25đ)
CuCO3 + H2O→ Cu(OH)2 + CO2 (0,25đ)
Câu 2:
MgCO3→ MgO + CO2 (1) (0,1đ)
CaCO3 →CaO + CO2 (2) (0,1đ)
BaCO3 →BaO + CO2 (3) (0,1đ)
CO2 + Ca(OH)2 -> CaCO3 + H2O (4) (0,1đ)
2 CO2 + Ca(OH)2 -> Ca(HCO3)2 (5) (0,1đ)
Ca(HCO3)2 → CaCO3 + H2O + CO2 (6) (0,1đ)
Gọi số mol của: MgCO3, CaCO3, BaCO3 lần lượt là x, y,z (x,y,z >0)
Từ PT (4) ta có: nCaCO3 = 0,1mol (0,1đ)
Từ PT (6) ta có: nCaCO3 = 0,06mol (0,1đ)
Theo PT 4,5,6 Ta có nCO2 = nCaCO3(4) + 2nCaCO3 (6) (0,1đ)
Vậy số mol CO2 ở PT 1,2,3 là: nCO2 = 0,1+0,06x2= 0,22mol (0,1đ)
Theo PT 1,2,3: Tổng số mol 3 muối cacbonnat =nCO2= 0,22 mol -> ta có (0,1đ)
84x + 100y + 197z = 20 -> 100y +197z = 20- 84x (0,15đ)
x + y + z = 0,22 -> y + z = 0,22 -x (0,25đ)
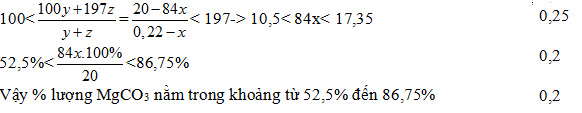
Câu 3:
1. nCO= 5,6 : 22,4= 0,25 (mol) (0,1đ)
nKOH = 400x1/1000= 0,4 (mol) (0,1đ)
Ta có: 1<0.4/0.25 < 2 Sản phẩm tạo 2 muối. (0,1đ)
CO2 + 2NaOH →Na2CO3 + H2O (1) (0,15đ)
x 2x x
CO2 + NaOH → NaHCO3 (2) (0,15đ)
y y y
Gọi số mol của CO2 trong PTHH 1, 2 lần lượt là x, y (0,2đ)
Ta có: x+y = 0,25
2x + y = 0,4
Giải ra ta được x= 0,15 , y = 0,1 (0,2đ)
mNaCO= 0,15 x 106= 15,9 g
mNaHCO= 0,1 x 84 = 8,4 g
mmuối = 15,9+8,4= 24,3 g
2.
PTHH: FeO + CO →Fe + CO2 (0,1đ)
Fe2O3 + 3 CO2 → Fe + 3 CO2 (0,1đ)
Fe3O4 + 4 CO3 →Fe + 4 CO2 (0,1đ)
CO2 + Ca(OH)2 →CaCO3 + H2O (0,1đ)
nCaCO= 40 : 100= 0,4 mol (0,1đ)
Theo các PTHH trên nO trong các oxit = nCaCO= 0,4 mol (0,1đ)
nO = 0,4 x 16 = 6,4 gam (0,2đ)
m = 64+ 6,4 = 70,4 gam (0,2đ)
Câu 4:
a. Gọi a, b là số mol của RCln và BaCl2 có trong 2,665 gam mỗi phần
Phần 1: RCln + n AgNO3 → R(NO3)n + n AgCl (1)
a an a an (mol)
BaCl2 + 2 AgNO3 → Ba(NO3)2 + 2 AgCl (2)
b 2b b 2b (mol)
nAgCl = 5,74/ 143,5= 0,04 mol→ an + 2b = 0,04
Phần 2: BaCl2 + H2SO4 → BaSO4 + 2 HCl (3)
b b mol
2RCln + nH2SO4 → R2(SO4)n + 2nHCl (4)
Từ phản ứng (3) cứ 1 mol BaCl2 chuyển thành 1 mol BaSO4 khối lượng muối tăng 25 gam. Từ phản ứng (4) cứ 2 mol RCln chuyển thành 1 mol R2(SO4) khối lượng tăng 12,5 n gam. Nhưng khối lượng X3 < m hỗn hợp muối ban đầu. Chứng tỏ (4) không xảy ra. → X3 là BaSO4
Số mol BaSO4 =1,165/233 = 0,005 mol →b = 0,005 an = 0,03.
mhh = a(MR + 35,5n) + 0,005. 208 = 2,665=> aMR = 0,56
aMR/an = 0,56 / 0,03 => MR = 56/3 (n)
| n | 1 | 2 | 3 |
| MR | 18,7 | 37,3 | 56 (Fe) |
Vậy R là kim loại sắt Fe. Công thức hóa học của muối: FeCl3
b. số mol AgNO3 phản ứng theo PTHH (1), (2) =. 0,04 mol
số mol AgNO 3 dư = 0,05 - 0,04 = 0,01 mol
Dung dịch X2 gồm: Fe(NO3)3 (0,01 mol) m Fe(NO3)3 = 0,01. 142 = 1,42 g
Ba(NO3)2 (0,005 mol) -> mBa(NO3)2 = 0,005. 261= 1,305 g
AgNO3 dư (0,01 mol)-> mAgNO3 = 0,01 . 170 = 1,7 g
mdd= 200/2 + 100 - 5,74 = 194,26g
C% Fe(NO3)3= (1,42/194,25.100%= 0,73%
C% Ba(NO3)2 =(1,305/194,56).100%= 0,671%
C% AgNO3= (1,7/194,56).100% = 0,875%
Câu 5:
1. Phương trình hóa học (Mỗi PT đúng được 0,15 điểm)
1. 2Fe + 3Cl2 →2FeCl3
2. 2FeCl3 + Fe→ 3FeCl2
3. 2FeCl2 + Cl→ 2FeCl3
4. FeCl2 + 2NaOH →Fe(OH)2 +2 NaCl
5. 4Fe(OH)2 + 2H2O + O2 →4Fe(OH)3
6. 2Fe(OH)3→ Fe2O3 + 3H2O
7. 3 Fe2O3 + CO →2Fe3O4 + CO2
8. Fe3O4 +H2SO4 loãng → Fe2(SO4)3 + FeSO4 + 4H2O
2. Khi đốt kloại đã hoá hợp với oxi tạo ra oxit là chất rắn làm khối lượng tăng lên: (0,4đ)
3Fe + 2O2→ Fe3O4
4Al + 3O2 →2Al2O3
Khi đốt bông vải...do đã giảm đi lượng cacbon (giải phóng thành CO2 làm cho khối lượng bông vải giảm. (0,4đ)
C + O2 →CO2




