Khoa học tự nhiên 8 Cánh diều bài 5 trang 32, 33, 34, 35
Kỹ năng Tính theo phương trình hóa học là một nội dung trọng tâm và then chốt trong chương trình Khoa học tự nhiên 8 - Bộ sách Cánh diều (Bài 5).
Tài liệu này được VnDoc sưu tầm và tổng hợp, cung cấp lời Giải chi tiết và rõ ràng cho toàn bộ các bài tập trong sách giáo khoa. Nội dung được biên soạn bám sát khung chương trình, giúp các em học sinh nắm vững phương pháp giải các dạng bài tập định lượng cơ bản, từ đó làm chủ nội dung bài học và áp dụng hiệu quả kiến thức Hóa học.
Bài: Tính theo phương trình hóa học
Mở đầu trang 32 Bài 5 KHTN 8: Trong công nghiệp, người ta sản xuất nhôm từ aluminium oxide (Al2O3). Làm thế nào tính được khối lượng nguyên liệu cần dùng để sản xuất nhôm hoặc tính khối lượng nhôm tạo ra nếu biết khối lượng nguyên liệu đã dùng?
Trả lời:
Dựa vào khối lượng nguyên liệu đã dùng, hiệu suất phản ứng và phương trình hoá học có thể tính được khối lượng nguyên liệu cần dùng để sản xuất nhôm hoặc tính khối lượng nhôm tạo ra.
I. Xác định khối lượng, số mol của chất phản ứng và sản phẩm trong phản ứng hóa học
Luyện tập 1 trang 33 KHTN 8: Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng:
Al + O2 → Al2O3
Lập phương trình hóa học của phản ứng rồi tính:
a) Khối lượng aluminium oxide tạo ra.
b) Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Trả lời:
Phương trình hóa học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
![]() \(n_{Al}=\frac{m_{Al}}{M_{Al}}=\frac{0,54}{27}=0,02(mol).\)
\(n_{Al}=\frac{m_{Al}}{M_{Al}}=\frac{0,54}{27}=0,02(mol).\)
a) Từ phương trình hóa học ta có:
![]() \(n_{Al2O3}=\frac{1}{2}.n_{Al}=0,01(mol);\ m_{Al2O3}=0,01.(27.2+16.3)=1,02(gam).\)
\(n_{Al2O3}=\frac{1}{2}.n_{Al}=0,01(mol);\ m_{Al2O3}=0,01.(27.2+16.3)=1,02(gam).\)
b) Từ phương trình hóa học ta có:
![]() \(n_{O2}=\frac{3}{4}.n_{Al}=\frac{3}{4}.0,02=0,015(mol).⇒VO2=0,015.24,79=0,37185(lit).\)
\(n_{O2}=\frac{3}{4}.n_{Al}=\frac{3}{4}.0,02=0,015(mol).⇒VO2=0,015.24,79=0,37185(lit).\)
II. Hiệu suất phản ứng
Câu hỏi 1 trang 33 KHTN 8: Đốt cháy 1 mol khí hydrogen trong 0,4 mol khí oxygen đến khi phản ứng xảy ra hoàn toàn. Cho biết chất nào còn dư sau phản ứng.
Trả lời:
Phương trình hoá học: 2H2 + O2 → 2H2O
Tỉ lệ số phân tử: 2 1 2
Ban đầu: 1 0,4 0 mol
Phản ứng: 0,8 0,4 0,8 mol
Sau phản ứng: 0,2 0 0,8 mol
Vậy sau phản ứng H2 dư 0,2 mol.
Câu hỏi 2 trang 34 KHTN 8:
a) Hiệu suất phản ứng được tính bằng cách nào?
b) Khi nào hiệu suất của phản ứng bằng 100%?
Trả lời:
a) Thông thường, hiệu suất phản ứng biểu thị theo phần trăm và được tính theo biểu thức sau:
![]() \(H=\frac{mtt\times100}{mlt}(\%)\)
\(H=\frac{mtt\times100}{mlt}(\%)\)
Trong đó:
mtt là khối lượng chất (g) thu được theo thực tế.
mlt là khối lượng chất (g) thu được theo lí thuyết (tính theo phương trình).
H là hiệu suất phản ứng (%).
b) Hiệu suất phản ứng là 100% tức là phản ứng hoá học xảy ra hoàn toàn.
Vận dụng trang 35 KHTN 8: Trong công nghiệp, nhôm được sản xuất từ aluminium oxide (Al2O3) theo phương trình hóa học sau:
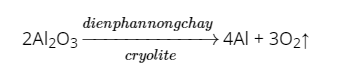
a) Tính hiệu suất phản ứng khi điện phân 102 kg Al2O3, biết khối lượng nhôm thu được sau phản ứng là 51,3 kg.
b*) Biết khối lượng nhôm thu được sau điện phân là 54 kg và hiệu suất phản ứng là 92%, tính khối lượng Al2O3 đã dùng.
Trả lời:
a) Phương trình hoá học:
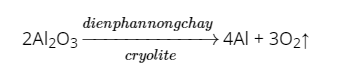
Giả sử: 2 → 4 mol
Khối lượng: (2 . 102) → (4 . 27) gam
Khối lượng lí thuyết: 102 → x kg
Điện phân 102 kg Al2O3, khối lượng Al thu được theo lí thuyết là:
![]() \(m_{lt}=x=\frac{102.4.27}{2}=54(kg)\)
\(m_{lt}=x=\frac{102.4.27}{2}=54(kg)\)
Hiệu suất phản ứng là:
![]() \(H=\frac{mtt\times100}{mlt}(\%)=\frac{51,3\times100}{54(\%)}=95(\%).\)
\(H=\frac{mtt\times100}{mlt}(\%)=\frac{51,3\times100}{54(\%)}=95(\%).\)
b) Phương trình hóa học:
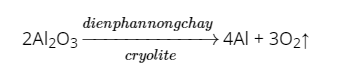
Giả sử khối lượng: (2 . 102) → (4 . 27) gam
Khối lượng lí thuyết: y → 54 kg
Khối lượng Al2O3 cần dùng theo lí thuyết là:
![]() \(mlt=y=\frac{54.2.102}{4.27}=102(kg)\)
\(mlt=y=\frac{54.2.102}{4.27}=102(kg)\)
Do H = 92% nên khối lượng Al2O3 đã dùng là:
![]() \(H=\frac{mlt\times100}{mtt}(\%)⇒mtt=\frac{102\times100(\%)}{92(\%)}=110,87(kg).\)
\(H=\frac{mlt\times100}{mtt}(\%)⇒mtt=\frac{102\times100(\%)}{92(\%)}=110,87(kg).\)
Chú ý: Hiệu suất phản ứng tính theo chất tham gia phản ứng là: ![]() \(H=\frac{mlt\times100}{mtt(\%)}\)
\(H=\frac{mlt\times100}{mtt(\%)}\)
-------------------------------------
Trên đây, VnDoc đã gửi tới các bạn Giải Khoa học tự nhiên 8 bài 5: Tính theo phương trình hóa học CD.
Bắt đầu năm học 2023 - 2024 trở đi sẽ được giảng dạy theo 3 bộ sách: Chân trời sáng tạo; Kết nối tri thức với cuộc sống và Cánh diều. Việc lựa chọn giảng dạy bộ sách nào sẽ tùy thuộc vào các trường. Để giúp các thầy cô và các em học sinh làm quen với từng bộ sách mới, VnDoc sẽ cung cấp lời giải bài tập sách giáo khoa, sách bài tập, trắc nghiệm toán từng bài và các tài liệu giảng dạy, học tập khác. Mời các bạn tham khảo qua đường link bên dưới:
- Khoa học tự nhiên 8 Chân trời sáng tạo
- Khoa học tự nhiên 8 Kết nối tri thức
- Khoa học tự nhiên 8 Cánh diều