Khoa học tự nhiên 8 Chân trời sáng tạo bài Ôn tập chủ đề 2 trang 75, 76
Chúng tôi xin giới thiệu bài Giải Khoa học tự nhiên 8 Chân trời sáng tạo bài: Ôn tập chủ đề 2 được VnDoc sưu tầm và tổng hợp với lời giải chi tiết, rõ ràng theo khung chương trình sách giáo khoa Khoa học tự nhiên 8 Chân trời sáng tạo. Mời các em cùng tham khảo để nắm được nội dung bài học
Ôn tập chủ đề 2
Bài 1 trang 75 Khoa học tự nhiên 8: Mô tả các hiện tượng xảy ra khi:
a) Cho một mẩu giấy quỳ tím vào dung dịch NaOH, sau đó thêm từ từ dung dịch HCl vào cho đến dư.
b) Cho từ từ dung dịch NaOH đến dư vào ống nghiệm dựng dung dịch HCl có nhỏ vài giọt dung dịch phenolphthalein.
Trả lời:
a) Cho một mẩu giấy quỳ tím vào dung dịch NaOH quỳ tím có màu xanh, sau đó thêm từ từ dung dịch HCl vào cho đến dư quỳ tím chuyển sang màu đỏ.
b) Dung dịch chuyển từ không màu sang màu hồng.
Bài 2 trang 75 Khoa học tự nhiên 8: Chỉ dùng dung dịch NaOH, hãy phân biệt mỗi dung dịch trong các dãy sau:
a) Dung dịch NaCl, dung dịch CuSO4 và dung dịch MgCl2.
b) Dung dịch Na2SO4, dung dịch FeCl2, dung dịch CuSO4 và dung dịch MgSO4.
Trả lời:
a) Trích mẫu thử.
Cho lần lượt từng mẫu thử tác dụng với dung dịch NaOH.
+ Không có hiện tượng xuất hiện → mẫu thử là NaCl.
+ Xuất hiện kết tủa trắng → mẫu thử là MgCl2:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
+ Xuất hiện kết tủa xanh → mẫu thử là CuSO4:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
b) Trích mẫu thử.
Cho lần lượt từng mẫu thử tác dụng với dung dịch NaOH.
+ Không có hiện tượng xuất hiện → mẫu thử là Na2SO4.
+ Xuất hiện kết tủa trắng → mẫu thử là MgSO4.
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
+ Xuất hiện kết tủa xanh → mẫu thử là CuSO4:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
+ Xuất hiện kết tủa trắng xanh, sau một thời gian kết tủa chuyển sang nâu đỏ → FeCl2:
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
4Fe(OH)2↓ + O2 + 2H2O → 4Fe(OH)3↓
Bài 3 trang 76 Khoa học tự nhiên 8: Có các muối: BaCO3, CuCl2, MgSO4. Hãy cho biết muối nào có thể được điều chế bằng các phương pháp sau:
a) Oxide acid phản ứng với dung dịch base.
b) Oxide base phản ứng với dung dịch acid.
c) Base phản ứng với dung dịch acid.
Viết phương trình hoá học của các phản ứng trên.
Trả lời:
Muối được điều chế bằng phương pháp:
a) Oxide acid phản ứng với dung dịch base là: BaCO3.
Ba(OH)2 + CO2 → BaCO3↓ + H2O.
b) Oxide base phản ứng với dung dịch acid: CuCl2, MgSO4.
CuO + 2HCl → CuCl2 + H2O
MgO + H2SO4 → MgSO4 + H2O
c) Base phản ứng với dung dịch acid: CuCl2, MgSO4.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
Bài 4 trang 76 Khoa học tự nhiên 8: Sodium sulfite được xem là hoá chất công nghiệp. Nó được dùng trong công nghiệp sản xuất giấy, thuộc da, dệt, nhuộm, …
a) Viết phương trình hoá học của phản ứng tạo sodium sulfite từ sulfur dioxide.
b) Từ phương trình hóa học trên, tính thể tích sulfur dioxide (đkc) để tạo ra 1,26 gam sodium sulfide.
Trả lời:
a) Phương trình hoá học: SO2 + 2NaOH → Na2SO3 + H2O
Tỉ lệ phản ứng: 1 2 1 1
b) Theo bài ra:
![]() \(n_{Na2SO3}=\frac{1,26}{126}=0,01(mol)\)
\(n_{Na2SO3}=\frac{1,26}{126}=0,01(mol)\)
Theo phương trình hóa học:
![]() \(n_{SO2}=n_{Na2SO}3=0,01(mol)⇒V_{SO2}=0,01\times24,79=0,2479(L).\)
\(n_{SO2}=n_{Na2SO}3=0,01(mol)⇒V_{SO2}=0,01\times24,79=0,2479(L).\)
Bài 5 trang 76 Khoa học tự nhiên 8: Hình vẽ sau đây giới thiệu các giá trị pH của một số sản phẩm hàng ngày:
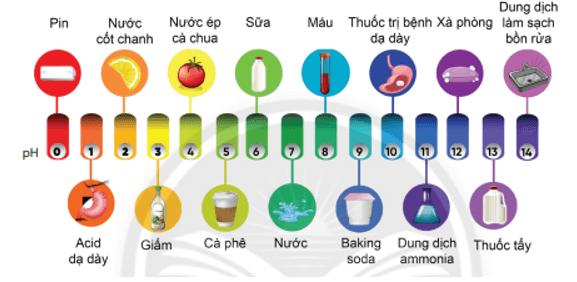
Hãy quan sát và trả lời các câu hỏi sau:
a) Giữa sữa và cam, loại nào có tính acid mạnh hơn?
b) Giữa xà phòng và dung dịch làm sạch bồn rửa, loại nào có tính base mạnh hơn?
c) Sản phẩm nào trung tính (không có tính acid hay tính base)?
d) Sản phẩm nào có tính acid mạnh nhất được hiển thị trong thang pH ở trên?
e) Sản phẩm nào có tính base mạnh nhất được hiển thị trong thang pH ở trên?
Trả lời:
a) Giữa sữa và cam, loại có tính acid mạnh hơn là cam.
b) Giữa xà phòng và dung dịch làm sạch bồn rửa, loại có tính base mạnh hơn là dung dịch làm sạch bồn rửa.
c) Sản phẩm trung tính (không có tính acid hay tính base) là nước.
d) Sản phẩm có tính acid mạnh nhất được hiển thị trong thang pH ở trên là pin.
e) Sản phẩm có tính base mạnh nhất được hiển thị trong thang pH ở trên là dung dịch làm sạch bồn rửa.
Bài 6 trang 76 Khoa học tự nhiên 8: Một số vật dụng bằng nhôm lúc còn mới có vẻ sáng bóng. Sau một thời gian, ta thấy lớp sáng bóng bị mờ đi. Hãy giải thích bằng phương trình hoá học.
Trả lời:
Sau một thời gian lớp sáng bóng bị mờ đi do lớp nhôm phía ngoài vật dụng phản ứng với oxygen có trong không khí.
4Al + 3O2 → 2Al2O3
Bài 7 trang 76 Khoa học tự nhiên 8: Tro bếp (hình bên) là sản phẩm đốt rơm rạ, cây thân gỗ hoặc củi khi đun nấu, ... Tìm hiểu qua sách, báo và internet, hãy cho biết tro bếp có chứa nguyên tố dinh dưỡng nào (đa lượng, trung lượng, vi lượng).
Trả lời:
Tro bếp có chứa potassium (kali, K). Đây là nguyên tố đa lượng.
Bài 8 trang 76 Khoa học tự nhiên 8: Hàm lượng dinh dưỡng của phân kali được tính bằng %K2O theo khối lượng có trong phân bón. Một loại phân kali có chứa 85% potassium chloride, 15% còn lại là các chất không chứa potassium. Hãy tính hàm lượng dinh dưỡng của loại phân kali này.
Trả lời:
Giả sử có 100 gam phân kali.
⇒ Khối lượng potassium chloride có trong 100 gam phân này là 85 gam.
![]() \(⇒n_{KCl}=\frac{85}{74,5}=\frac{170}{149}(mol)\)
\(⇒n_{KCl}=\frac{85}{74,5}=\frac{170}{149}(mol)\)
Bảo toàn nguyên tố K có:
![]() \(n_{K2O}=\frac{1}{2}\times n_{KCl}=\frac{1}{2}\times\frac{170}{149}=\frac{85}{149}(mol).\)
\(n_{K2O}=\frac{1}{2}\times n_{KCl}=\frac{1}{2}\times\frac{170}{149}=\frac{85}{149}(mol).\)
Hàm lượng dinh dưỡng của loại phân kali này là:
![]() \(\frac{\frac{85}{149}\ \times94}{100}\times100=53,62\%.\)
\(\frac{\frac{85}{149}\ \times94}{100}\times100=53,62\%.\)
Bài 9 trang 76 Khoa học tự nhiên 8: Magnesium chloride có nhiều ứng dụng trong y tế như: bào chế thuốc điều trị các bệnh về da, nhuận tràng…
a) Viết phương trình hoá học của phản ứng tạo magnesium chloride từ magnesium oxide.
b) Cho 8 gam magnesium oxide tác dụng hết với dung dịch HCl 2 M. Tính khối lượng magnesium chloride thu được và thể tích dung dịch HCl 2 M đã dùng.
Trả lời:
a) Phương trình hóa học: MgO + 2HCl → MgCl2 + H2O
Tỉ lệ phản ứng: 1 2 1 1
b)
![]() \(n_{MgO}=\frac{8}{40}=0,2(mol)\)
\(n_{MgO}=\frac{8}{40}=0,2(mol)\)
Theo phương trình hóa học ta có:
![]() \(n_{MgCl2}=n_{MgO}=0,2(mol)⇒m_{MgCl2}=0,2.95=19(gam)\)
\(n_{MgCl2}=n_{MgO}=0,2(mol)⇒m_{MgCl2}=0,2.95=19(gam)\)
![]() \(n_{HCl}=2.n_{MgO}=0,4(mol)⇒V_{HCl}=\frac{0,4}{2}=0,2(L).\)
\(n_{HCl}=2.n_{MgO}=0,4(mol)⇒V_{HCl}=\frac{0,4}{2}=0,2(L).\)
-------------------------------------
Trên đây, VnDoc đã gửi tới các bạn Giải Khoa học tự nhiên 8 bài: Ôn tập chủ đề 2 CTST.
Bắt đầu năm học 2023 - 2024 trở đi sẽ được giảng dạy theo 3 bộ sách: Chân trời sáng tạo; Kết nối tri thức với cuộc sống và Cánh diều. Việc lựa chọn giảng dạy bộ sách nào sẽ tùy thuộc vào các trường. Để giúp các thầy cô và các em học sinh làm quen với từng bộ sách mới, VnDoc sẽ cung cấp lời giải bài tập sách giáo khoa, sách bài tập, trắc nghiệm toán từng bài và các tài liệu giảng dạy, học tập khác. Mời các bạn tham khảo qua đường link bên dưới:
- Khoa học tự nhiên 8 Chân trời sáng tạo
- Khoa học tự nhiên 8 Kết nối tri thức
- Khoa học tự nhiên 8 Cánh diều








